Structurele eiwitten dienen voornamelijk als trekopbouwers in cellen en weefsels. Ze hebben meestal geen enzymatische functie, dus interfereren ze normaal gesproken niet met metabolische processen. Structurele eiwitten vormen meestal lange vezels en geven z. B. ligamenten, pezen en botten hun kracht en beweeglijkheid, hun mobiliteit. Verschillende soorten structurele eiwitten vormen ongeveer 30% van alle eiwitten die bij mensen voorkomen.
Wat is het structurele eiwit?
Eiwitten, die het weefsel voornamelijk hun structuur en scheurweerstand geven, worden samengevat onder de term structurele eiwitten. Structurele eiwitten worden gekenmerkt door het feit dat ze meestal niet betrokken zijn bij enzymatisch-katalytische metabolische processen.
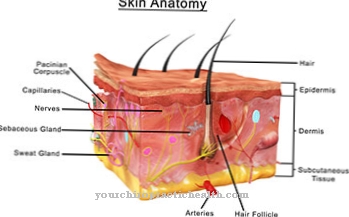
Scleroproteïnen, die tot de structurele eiwitten worden gerekend, vormen gewoonlijk moleculen met een lange keten in de vorm van aaneengeregen aminozuren, die elk met elkaar zijn verbonden via peptidebindingen. Structurele eiwitten hebben vaak terugkerende aminozuursequenties, waardoor de moleculen speciale secundaire en tertiaire structuren krijgen, zoals dubbele of driedubbele helices, wat leidt tot een bijzondere mechanische sterkte. Belangrijke en bekende structurele eiwitten zijn z. B. Keratine, collageen en elastine. Keratine is een van de vezelvormende structurele eiwitten die zowel structuur geven aan de huid (epidermis) als aan haar en nagels.
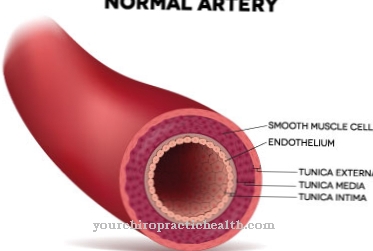
Met meer dan 24% van alle eiwitten die in het menselijk lichaam voorkomen, vormen collagenen de grootste groep structurele eiwitten. Opvallend aan collagenen is dat elk derde aminozuur glycine is en dat de sequentie glycine-proline-hydroxyproline wordt opgebouwd. De scheurvaste collagenen zijn de belangrijkste componenten van botten, tanden, ligamenten en pezen (bindweefsel). In tegenstelling tot collagenen, die nauwelijks kunnen worden uitgerekt, geeft elastine bepaalde weefsels de mogelijkheid om uit te rekken. Elastine is daarom een belangrijk bestanddeel in de longen, in de wanden van bloedvaten en in de huid.
Functie, effect en taken
Onder de term structureel eiwit vallen verschillende klassen eiwitten. Wat alle structurele eiwitten gemeen hebben, is dat hun belangrijkste functie is om structuur en sterkte te geven aan het weefsel waarin ze worden aangetroffen. Er is een breed scala aan noodzakelijke structurele eigenschappen vereist. Collagenen, die het structurele eiwit vormen in onder meer ligamenten en pezen, zijn extreem scheurvast, aangezien de ligamenten en pezen aan hoge belastingen worden blootgesteld in termen van scheurweerstand.
Als onderdeel van botten en tanden moeten de collagenen ook breukvaste structuren kunnen vormen. Naast scheurweerstand hebben andere lichaamsweefsels een speciale elasticiteit nodig om zich aan de betreffende omstandigheden aan te passen. Structurele eiwitten, die tot de groep van elastines behoren, vervullen deze taak. Ze zijn rekbaar en in beperkte mate vergelijkbaar met elastische vezels in stof. Elastines maken snelle volumeaanpassingen mogelijk in bloedvaten, longen en verschillende huiden en membranen die organen omhullen en te maken hebben met veranderende orgaangroottes. Ook in de menselijke huid vullen collagenen en elastines elkaar aan om zowel stevigheid als het vermogen om de huid te bewegen te verzekeren.
Waar collagenen in ligamenten en pezen vooral de treksterkte in een bepaalde richting garanderen, moeten keratines, die deel uitmaken van vingernagels en teennagels, zorgen voor platte (tweedimensionale) sterkte. Een andere klasse van structurele eiwitten bestaat uit zogenaamde motoreiwitten, die het hoofdbestanddeel vormen van spiercellen. Myosine en andere motoreiwitten hebben het vermogen om samen te trekken als reactie op een bepaalde neurale stimulus, waardoor de spier tijdelijk korter wordt tijdens het gebruik van energie.
Opleiding, voorkomen en eigenschappen
Structurele eiwitten worden, net als andere eiwitten, in cellen gesynthetiseerd. Voorwaarde is dat de aanvoer van de bijbehorende aminozuren gegarandeerd is. Ten eerste zijn verschillende aminozuren gekoppeld om peptiden en polypeptiden te vormen. Deze delen van een eiwit worden op het ruwe endoplasmatisch reticulum samengebracht om grotere delen te vormen en vervolgens om een compleet eiwitmolecuul te vormen.
Structurele eiwitten die functies moeten vervullen buiten de cellen in de extracellulaire matrix worden gemarkeerd en door exocytose door middel van secretoire vesikels naar de extracellulaire ruimte getransporteerd. De vereiste eigenschappen van de structurele eiwitten bestrijken een breed spectrum tussen treksterkte en elasticiteit. Structurele eiwitten komen normaal gesproken alleen voor als onderdeel van weefsels, zodat hun concentratie niet gemakkelijk direct kan worden gemeten. Een optimale concentratie kan daarom niet worden gegeven.
Ziekten en aandoeningen
De complexe taken die de verschillende structurele eiwitten op zich moeten nemen, leiden tot de verwachting dat er ook storingen kunnen optreden die leiden tot aandoeningen en symptomen. Het kan ook leiden tot storingen in de syntheseketen omdat voor de synthese een groot aantal enzymen en vitamines nodig zijn.
De meest opvallende verstoringen treden op wanneer de corresponderende eiwitten niet kunnen worden gesynthetiseerd vanwege een onderaanbod aan aminozuren. Het merendeel van de benodigde aminozuren kan door het lichaam zelf worden aangemaakt, maar niet de essentiële aminozuren die van buitenaf in de vorm van voeding of voedingssupplementen moeten worden opgenomen. Zelfs bij voldoende aanvoer van essentiële aminozuren kan de opname in de dunne darm verstoord worden door ziektes of door ingenomen gifstoffen of als bijwerking van bepaalde medicijnen en een tekort veroorzaken. Een bekende, zij het zeldzame, ziekte in deze context is de spierdystrofie van Duchenne.
De ziekte wordt veroorzaakt door een genetisch defect op het X-chromosoom, dus alleen mannen worden direct getroffen. Door het genetische defect kan het structurele eiwit dystrofine, dat verantwoordelijk is voor de verankering van de spiervezels van de skeletspieren, niet worden gesynthetiseerd. Dit leidt tot een spierdystrofie met een ernstig beloop. Een andere - ook zeldzame - erfelijke ziekte leidt tot mitochondriopathie. Verschillende bekende genetische defecten in DNA en mitochondriaal DNA kunnen mitochondriën veroorzaken. Een veranderde samenstelling van bepaalde mitochondriale structurele eiwitten resulteert in een verminderde energievoorziening voor het hele organisme.




.jpg)