Van de Bayliss-effect houdt de bloedtoevoer naar organen zoals de hersenen en nieren constant ondanks dagelijkse schommelingen in de bloeddruk. Bij verhoogde drukwaarden veroorzaakt het effect vasoconstrictie van de vaatspieren. Verstoringen van het Bayliss-effect leiden tot aanhoudende hyperemie en oedeemvorming in de extracellulaire ruimte.
Wat is het Bayliss-effect?

Bloeddrukwaarden zijn onderhevig aan schommelingen van dag tot dag. Ondanks deze schommelingen moet de bloedstroom van het orgaan constant worden gehouden. Het Bayliss-effect draagt bij aan het constante behoud van de bloedstroom van organen. Deze myogene autoregulatie werd voor het eerst beschreven door de Britse fysioloog Bayliss en komt overeen met een samentrekkingsreactie van de bloedvaten, die de constantheid van de bloedstroom in organen en weefsels handhaaft als onderdeel van de lokale controle in de bloedbaan.
De bloedvaten zijn uitgerust met gladde spieren. Wanneer de bloeddruk verandert, reageren de vasculaire spiercellen op de nieuwe situatie door samentrekken of ontspannen. De activering van mechano-gevoelige receptoren in de bloedvaten wordt beschouwd als de moleculaire oorzaak van het Bayliss-effect. Het Bayliss-effect komt uiteindelijk overeen met een variant van de bloedsomloopregulatie die onafhankelijk is van het vegetatieve zenuwstelsel en zijn zenuwvezels. Hoewel het effect is aangetoond voor de nieren, het maagdarmkanaal en de hersenen, lijkt het fenomeen geen rol te spelen in de huid en longen.
Functie en taak
Wanneer de bloedstroom in de kleine slagaders of arteriolen toeneemt als gevolg van verhoogde bloeddrukwaarden, veroorzaakt dit vasoconstrictie.Dit is de samentrekking van de gladde vaatspieren, die in dit geval overeenkomt met een reactie op een drukprikkel en daarom in de breedste zin een reflex kan worden genoemd. De mechanoreceptoren in de vaten registreren de verandering in druk en veroorzaken de vasoconstrictie. Dit verhoogt de stromingsweerstand in de aangetaste vaten. De bloedstroom in het aanvoergebied van de bloedvaten blijft ondanks schommelingen in de bloeddruk constant.
Zodra de mechanoreceptoren in de bloedvaten weer lagere bloeddrukwaarden registreren en dus een afname van de bloedstroom registreren, wordt vaatverwijding geïnitieerd. De spieren van de vaten ontspannen weer tot hun basale tonus. Op deze manier houdt het Bayliss-effect de bloedstroom naar de nieren, het maagdarmkanaal en de hersenen grotendeels constant en reguleert het de waarden in deze delen van het lichaam relatief autonoom.
Het Bayliss-effect toont efficiëntie aan bij systolische bloeddrukwaarden van 100 tot 200 mmHg. Het effect is gebaseerd op moleculaire mechanismen. Slagaders en arteriolen met het Bayliss-effect hebben mechano-gevoelige kationkanalen in hun wanden. Wanneer deze kationkanalen worden geopend, stromen calciumionen de spiercellen binnen en vormen een complex met het eiwit calmoduline.
Wanneer het zich bindt aan een complex, wordt het enzym myosine lichte keten kinase geactiveerd. Wanneer fosforylering plaatsvindt in de zin van een onderlinge omzetting van dit kinase, wordt het motoreiwit myosine II geactiveerd. Dit motoreiwit zorgt ervoor dat vasculaire gladde spiercellen samentrekken.
Voor elke spiercontractie moeten de myosine- en Atkin-filamenten in de spier in elkaar glijden. Myosin II is bij deze beweging betrokken omdat het verantwoordelijk is voor de bindingsplaats aan het Atkin-filament van de spieren.
Het Bayliss-effect is een soort bloedsomloopregulatie die onafhankelijk werkt van de vegetatieve innervatie van de bloedvaten. Zelfs als de vegetatieve verbinding wordt verbroken door de toevoerende zenuwen door te snijden, blijft het Bayliss-effect behouden. Het mechanisme kan alleen worden geblokkeerd door het gebruik van antispasmodica zoals papaverine, die de vasculaire spiercellen ontspannen.
Ziekten en aandoeningen
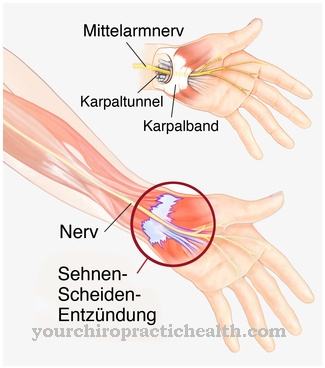
Een verstoring of zelfs annulering van het Bayliss-effect kan ernstige gevolgen hebben voor het organisme. Zo kan permanente hyperemie van de organen in het getroffen verzorgingsgebied het gevolg zijn. Hyperemie is een verhoogde bloedtoevoer naar een bepaald weefsel of orgaan, omdat het kan ontstaan als gevolg van de uitzetting van de toevoerende bloedvaten tijdens vasodilatatie. Hyperemie is meestal het begeleidende symptoom van een ontsteking en wordt meestal veroorzaakt door lokaal vrijgekomen mediatoren. Bovendien wordt hyperemie vaak geassocieerd met ischemie, wat verlies van spierspanning en een daarmee samenhangende afname van de wandspanning in de bloedvaten kan veroorzaken.
De annulering van het Bayliss-effect kan resulteren in de overdracht van vloeistof naar individuele orgaanstructuren als gevolg van de resulterende hyperemie van een bepaald leveringsgebied. Dit kan leiden tot extracellulair oedeem. Oedeem wordt voorafgegaan door het ontsnappen van vloeistof uit de bloedvaten, dat zich uiteindelijk ophoopt in de interstitiële ruimte. De vorming van oedeem wordt altijd voorafgegaan door een verandering in vloeistofbewegingen tussen het interstitium en de capillairen. De principes van de Starling-vergelijking spelen een grote rol bij de vloeistofafvoer.
Naast de hydrostatische druk van de bloedcapillairen speelt het verschil in oncotische vasculaire druk tussen de capillairen en de interstitiële ruimte een rol. De hydrostatische en oncotische druk werken tegen elkaar in. Terwijl de hydrostatische druk het lekken van water in de interstitiële ruimte veroorzaakt, bindt de oncotische druk vloeistof in de capillairen. De twee krachten zijn meestal bijna in evenwicht.
Oedeem kan alleen ontstaan in de context van afwijkende drukwaarden die niet meer in evenwicht zijn. Dergelijke abnormale drukwaarden treden bijvoorbeeld op wanneer het Bayliss-effect faalt. Omdat met name het ionkanaal TRPC6 betrokken is bij het Bayliss-effect, kunnen mutaties in het gen dat ervoor codeert, verstoringen in het effect veroorzaken. Inmiddels zijn bijvoorbeeld zeldzame erfelijke aandoeningen van de nieren terug te voeren op een mutatie in het TRPM6-gen. Mutaties kunnen het eiwit in het ionkanaal zo sterk veranderen dat het niet meer werkt. Een magnesiumtekort en een verstoorde calciumtoevoer in de cellen is het gevolg.














.jpg)


.jpg)