De complexe cellulaire en fysiologische processen bij levende wezens vereisen fijn afgestemde regulatie op moleculair niveau om het aanpassingsvermogen van bijvoorbeeld een dier of plant aan de habitat te verzekeren. Hiervoor zijn er tal van moleculen die tussenkomen in processen als celcommunicatie, metabolisme of celdeling. Een van deze moleculen is proteïne Calmodulindie met behulp van calcium de functie van vele andere biologisch actieve eiwitten beïnvloedt.
Wat is calmodulin?
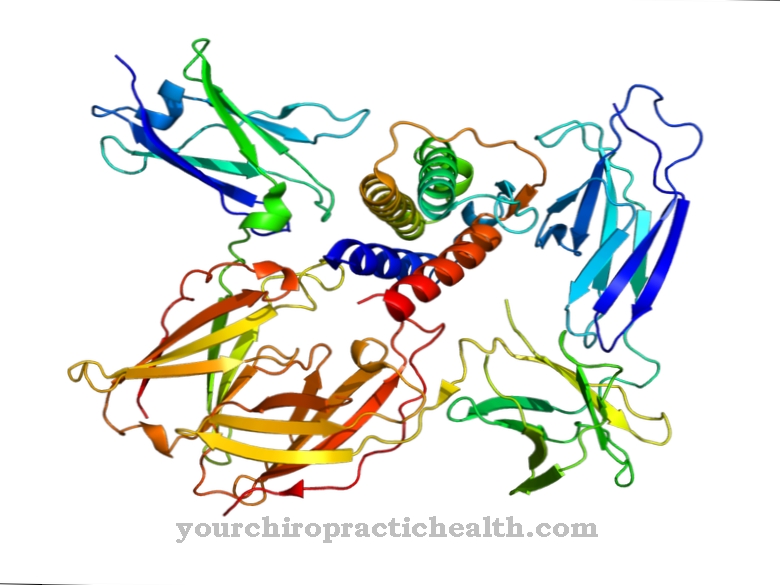
Calmoduline is een intracellulair regulerend eiwit dat calciumionen bindt. Vanwege zijn structuur behoort het tot de groep van EF-handproteïnen. De vorm van het calmoduline, dat uit 148 aminozuren bestaat en 6,5 nm lang is, lijkt op een halter. De molecuulmassa van dit eiwitmolecuul is ongeveer 17 kDa.
Vanwege zijn biologische functie bij de signaaloverdracht binnen cellen, kan calmoduline ook worden geclassificeerd als een tweede boodschapper, d.w.z. een secundaire boodschappersubstantie die echter zelf niet enzymatisch actief is. In de twee bolvormige domeinen van het eiwit bevinden zich twee helix-loop-helix-motieven op een afstand van 1,1 nm, waaraan in totaal vier calciumionen kunnen worden gebonden. Deze structuur staat bekend als de EF-hand. De EF-handstructuren zijn verbonden door waterstofbruggen tussen de antiparallelle bètavellen van calmoduline.
Functie, effect en taken
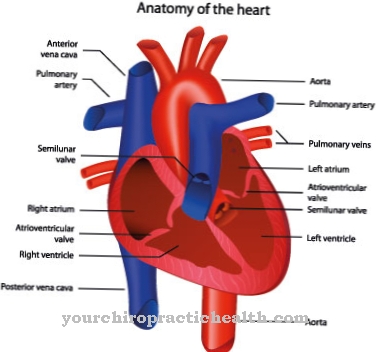
Calmodulin heeft drie tot vier gebonden calciumionen per molecuul nodig om actief te zijn. In geactiveerde toestand is het gevormde calcium-calmodulinecomplex betrokken bij de regulering van een groot aantal receptoren, enzymen en ionenkanalen met een grote verscheidenheid aan functies. De gereguleerde enzymen zijn onder meer het fosfatase calcineurine, dat een belangrijke rol speelt bij het reguleren van de immuunrespons, en het endotheliale stikstofoxidesynthase (eNOS), dat NO produceert, dat onder andere wordt gebruikt voor het ontspannen van gladde spieren en dus voor een uitbreiding van de Aderen.
Bij lage calciumconcentraties wordt adenylaatcyclase (AC) ook geactiveerd, bij hoge calciumconcentraties daarentegen de enzymatische tegenhanger, fosfodiësterase (PDE). Op deze manier wordt een chronologische volgorde van de reguleringsmechanismen bereikt: aanvankelijk zet de AC een signaalpad in beweging via de productie van cyclisch AMP (cAMP), later wordt dit weer uitgeschakeld door de tegenpartij PDE via cAMP-degradatie. Het regulerende effect van calmoduline op proteïnekinasen zoals CaM kinase II of myosine lichte keten kinase (MLCK), dat hieronder in meer detail zal worden toegelicht, is echter bijzonder bekend.
De CAMKII kan een fosfaatresidu aan verschillende eiwitten binden en daarmee het energiemetabolisme, de doorlaatbaarheid voor ionen en het vrijkomen van neurotransmitters uit de cellen beïnvloeden. De CAMKII wordt in bijzonder hoge concentraties in de hersenen aangetroffen, waar het een belangrijke rol speelt bij neuronale plasticiteit, d.w.z. alle leerprocessen. Maar ook bij bewegingsprocessen is calmodulin onmisbaar. In rust is de concentratie calciumionen in een spiercel erg laag en is calmoduline daarom inactief. Als de spiercel echter opgewonden is, stroomt calcium in het celplasma en bezet het als cofactor de vier bindingsplaatsen op calmoduline.
Dit kan nu de myosine lichte keten kinase activeren, die de contractiele vezels in de cel verschuift en zo spiercontractie mogelijk maakt. Andere, minder bekende enzymen die onder invloed staan van calmoduline zijn guanylaatcyclase, Ca-Mg-ATPase en fosfolipase A2.
Opleiding, voorkomen, eigenschappen en optimale waarden
Calmoduline komt voor in alle eukaryoten, waaronder alle planten, dieren, schimmels en de groep amoeboïde wezens. Omdat het calmodulinemolecuul in deze organismen meestal op een relatief vergelijkbare manier is gestructureerd, kan worden aangenomen dat het een evolutionair zeer oud eiwit is dat in een vroeg stadium is ontstaan.
Calmoduline is in de regel in relatief grote hoeveelheden aanwezig in het plasma van een cel. In het cytosol van zenuwcellen is de gebruikelijke concentratie bijvoorbeeld ongeveer 30-50 µM, d.w.z. 0,03-0,05 mol / L. Het eiwit wordt gevormd tijdens transcriptie en translatie met behulp van het CALM-gen, waarvan er tot op heden drie allelen bekend zijn, die CALM-1, CALM-2 en CALM-3 worden genoemd.
Ziekten en aandoeningen
Er zijn enkele chemicaliën die een remmend effect kunnen hebben op calmoduline en staan daarom bekend als calmoduline-remmers. In de meeste gevallen is hun remmende werking gebaseerd op het feit dat ze calcium uit de cel transporteren en zo uit het calmoduline verwijderen, dat dan alleen in inactieve toestand aanwezig is.
Deze remmende stoffen zijn bijvoorbeeld W-7. Bovendien remmen sommige psychotrope fenothiazinegeneesmiddelen calmoduline. Zo breed als de regulerende functies van calmoduline, zo divers zijn de denkbare defecten en aandoeningen wanneer het eiwit niet langer kan worden geactiveerd door de cofactor calcium en de gereguleerde doelenzymen zelf minder actief zijn. Ontoereikende activering van de CAMKII kan bijvoorbeeld leiden tot een beperking van de neurale plasticiteit, die de basis vormt voor leerprocessen.
Afnemende activering van de MLCK belemmert de samentrekking van spieren, wat kan leiden tot bewegingsstoornissen. Minder activering van het enzym calcineurine als gevolg van een calmoduline-deficiëntie zou de immuunrespons van het lichaam beïnvloeden en minder activering van de eNO's zou leiden tot lagere NO-concentraties. Dit laatste veroorzaakt vooral problemen waar anders het stikstofmonoxide verondersteld wordt ongewenste bloedstolling te voorkomen en de bloedvaten te verwijden ten behoeve van een betere doorbloeding. Op dit punt moet echter ook worden vermeld dat de calciumsensor Frequenin onder bepaalde omstandigheden de biologische functies van calmoduline kan overnemen en zo het molecuul kan vervangen.




.jpg)


.jpg)