Lysyloxidase is een enzym van het bindweefsel dat katalytische taken heeft en de verknoping van collageen en elastine bevordert. Het enzym heeft een stabiliserende werking op het bindweefsel door oxidatieve deaminering uit te voeren en zo de basisvoorwaarden voor verknoping te creëren. In Cutis laxa is de activiteit van lysyloxidase verminderd.
Wat is lysyloxidase?
Er zijn verschillende enzymen in het menselijk lichaam, die allemaal katalytische activiteit hebben. Enzymen maken reacties in het menselijk lichaam mogelijk of versnellen deze. Lysyloxidase is een enzym dat wordt aangetroffen in menselijk bindweefsel. Het wordt ook wel proteïne lysine 6 oxidase genoemd en komt voornamelijk voor in de extracellulaire ruimte van het bindweefsel.
De katalytische activiteit van het enzym heeft in dit geval betrekking op de verknoping tussen collageen en elastine. Lysyloxidase stabiliseert de twee eiwitten op mechanische wijze en maakt zo de reactieve verbinding mogelijk. Lysyloxidase wordt niet alleen in het menselijk lichaam aangetroffen. Andere gewervelde dieren zijn ook uitgerust met het enzym. Lysyloxidase wordt beschouwd als een stabilisator van het bindweefsel. Een tekort aan het enzym leidt tot het klinische beeld van cutis laxa, een ernstige en erfelijke zwakte van het bindweefsel.
Functie, effect en taken
Lysyloxidase neemt belangrijke taken op zich in de extracellulaire ruimte in de kruisverbinding tussen individuele collageenmoleculen. In het menselijk lichaam speelt collageen een grote rol binnen de eiwitten, met ongeveer 30 procent van de totale eiwitmassa.
Collageen is het meest voorkomende eiwit. Het is een structureel en bouwend eiwit dat veel delen van het lichaam vormt, zoals bindweefsel, botten, tanden, kraakbeen, pezen, ligamenten en huid. Lysyloxidase ondersteunt de binding van collageen aan carbonylgroepen en draagt zo bij aan de stabiliteit van de genoemde lichaamscomponenten. Het heeft een katalytische activiteit voor de productie van carbonylgroepen die covalente verknopingen vormen op collagenen in aldolcondensaties. De katalytische taak van lysyloxidase is daarom om zich voor te bereiden op fibrilvorming. Het enzym creëert alle chemische omstandigheden die nodig zijn voor de vorming.
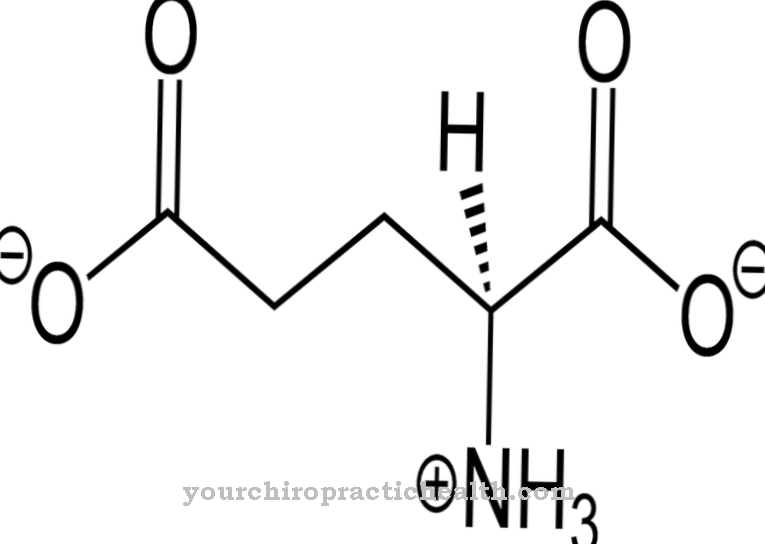
Fibrillen worden beschouwd als vezels van vezels. Ze komen overeen met dunne en vezelige delen van het lichaam en worden aangetroffen in celwanden van planten, in menselijke spieren en in bindweefsel. De taak van lysyloxidase in deze context is in wezen de oxidatieve deaminering van lysylresten. In de chemie is deaminering de chemische afsplitsing van aminogroepen als ammoniumionen of ammoniak. Oxidatieve deaminering splitst aminogroepen van het aminozuur L-glutamaat van waterstof en oxideert ze tot iminogroepen met de overdracht van waterstof naar NAD + of NADP +.
Dit wordt gevolgd door hydrolytische splitsing van iminogroepen als ammoniumionen, wat wordt geassocieerd met de vorming van α-ketozuur. Deaminering komt overeen met de eerste stap in de biochemische afbraak van aminozuren, die bij zoogdieren voornamelijk plaatsvindt in de lever. Het ammoniumion dat tijdens het deamineren wordt gevormd, wordt omgezet in ureum. De deamineringsprocessen van het lysyloxidase geven aanleiding tot aldehydegroepen die, met de individuele aminogroepen van andere lysylresten, zogenaamde Schiffse basen vormen en op deze manier de stabiliserende verknopingen in het collageen kunnen vormen.
Opleiding, voorkomen, eigenschappen en optimale waarden
Lysyloxidase in het DNA wordt gecodeerd door het LOX-gen, dat bij mensen op chromosoom 5 in de genlocus q23.3 tot q31.2 ligt. Het genproduct is niet de uiteindelijke vorm van het enzym. Het product is geen afgewerkt lysyloxidase, maar een voorgangervorm die na translatie een molaire massa heeft van 47 kDa.
Glycosylering vindt plaats in het verdere verloop. Tijdens dit proces neemt de molaire massa van het latere enzym toe tot 50 kDa en wordt de voorganger van lysyloxidase uitgescheiden in de extracellulaire ruimte. Na secretie wordt het pre-pro-lysyloxidase verder verwerkt. De stof is gespleten in de extracellulaire ruimte. Eiwit 1 is verantwoordelijk voor de splitsing in twee fragmenten Op deze manier wordt enerzijds het 32 kDa lysyloxidase geproduceerd. Aan de andere kant ontstaat er een reststof, die in dit geval overeenkomt met een polypeptide.
Ziekten en aandoeningen
Genetische defecten in lysyloxidase kunnen het klinische beeld van cutix laxe veroorzaken. Deze ziekte wordt ook wel dermatochalasis genoemd en verwijst naar een groep vaak aan leeftijd gerelateerde zwakheden van het bindweefsel, die in de meeste gevallen worden waargenomen bij familiale accumulatie.
Het gemeenschappelijke kenmerk van alle dermatochalasisverschijnselen is een slappe en onelastische huid, die vaak in grote plooien over verschillende delen van het lichaam naar beneden hangt. De meeste getroffenen zien er ouder uit dan ze zijn vanwege de veranderingen. De ziekten worden onder meer veroorzaakt door genetische mutaties. In deze context hebben we het over het cutis laxa-syndroom. De ziekte kan voorkomen in autosomaal recessieve, autosomaal dominante en x-chromsomale vormen. In veel gevallen wordt het cutis laxa-syndroom geassocieerd met andere anomalieën en kan het bijvoorbeeld dodelijk zijn als de organen erbij betrokken zijn.
ARCL1 komt overeen met een cutis laxa van het autosomaal recessieve type 1 en wordt beschouwd als de meest ernstige vorm die tot levensbedreigende complicaties kan leiden. De vorm ARCL1A is geassocieerd met mutaties in het FBLN5-gen op locus 14q32.12. Type ARCL1B is geassocieerd met mutaties in het EFEMP2-gen op locus 11q13.1 en variant ARCL1C komt overeen met een cutis laxa met bijbehorende anomalieën in de longen, gastro-intestinale en urinewegen, die het gevolg zijn van mutaties in het LTBP4-gen op locus 19q13.2.
De mutaties in de genoemde genen leiden tot een ondergemiddelde activiteit van lyxyloxidase. Door de verminderde activiteit van het enzym ontstaan er onvoldoende kruisverbindingen. Het bindweefsel van de patiënt is niet voldoende gestabiliseerd.





.jpg)

.jpg)
.jpg)


.jpg)