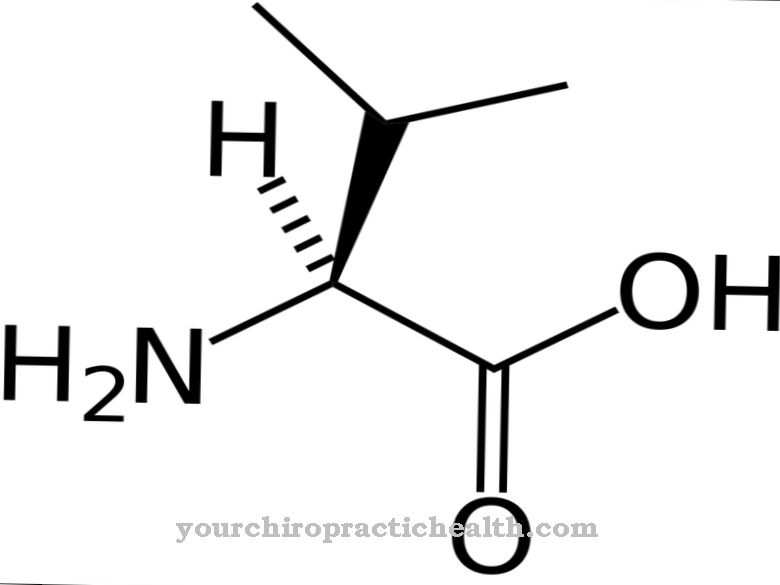
Methionine is het enige zwavelhoudende proteïnogene aminozuur naast cysteïne. Bij de eiwitsynthese neemt L-methionine - zijn natuurlijke en biochemisch actieve vorm - een bijzondere positie in omdat het altijd het eerste aminozuur vertegenwoordigt, de startstof waaruit een eiwit wordt samengesteld. L-methionine is essentieel en dient voornamelijk als leverancier van methylgroepen (-CH3) voor belangrijke hormonen zoals choline, adrenaline, creatine en nog veel meer.
Wat is methionine?
L-methionine (M of Met), de natuurlijke en bioactieve vorm van methionine, is een essentieel, proteïnogeen aminozuur. Naast cysteïne, dat op zijn beurt wordt gesynthetiseerd uit methionine, is het het enige zwavelhoudende aminozuur. L-methionine neemt een bijzondere positie in bij de synthese van eiwitten omdat het altijd het eerste aminozuur is, het startaminozuur, voor de structuur van elk eiwit.
Methionine wordt op het mRNA (boodschapper-RNA) gecodeerd door het nucleïnezuurbase-triplet adenine-uracil-guanine (AUG), dat ook bekend staat als het startcodon. Dit betekent dat elk mRNA begint met het startertriplet AUG. Om de eiwitsynthese te starten, moet het tRNA (transport-RNA) eerst L-methionine leveren voordat het volgende aminozuur kan worden gehecht.
Eiwitten bestaan uit een reeks van minstens 100 proteïnogene aminozuren, die elk via een peptidebinding met elkaar verbonden zijn. Naast zijn rol als bestanddeel van veel eiwitten, is L-methionine de belangrijkste leverancier van methylgroepen voor de synthese van hormonen zoals adrenaline, choline, creatine, histidine en nog veel meer. Daarnaast is L-methionine ook een bron van zwavel voor de synthese van bepaalde verbindingen in het lichaam.
Functie, effect en taken
In zijn biochemisch reactieve L-vorm vervult methionine functies op een hoger niveau in het metabolisme van het lichaam, evenals specifieke functies. Een bovengeschikte functie is om in feite het oorspronkelijke aminozuur van een eiwit te vormen.
Dit betekent dat de eiwitsynthese stilvalt als er niet genoeg L-methionine in het lichaam beschikbaar is. In veel gevallen wordt de methionine echter na het starten van de eiwitsynthese afgesplitst en gerecycled, zodat het weer beschikbaar is voor de volgende eiwitsynthese. Vooral bij sommige structurele eiwitten is L-methionine een belangrijke component die de structurele sterkte van ligamenten, pezen en fasciae beïnvloedt. De hardheid van vingernagels en teennagels en de sterkte van het haar zijn mede afhankelijk van het aantal zwavelbruggen in de keratine, waardoor methionine hier van groot belang is.
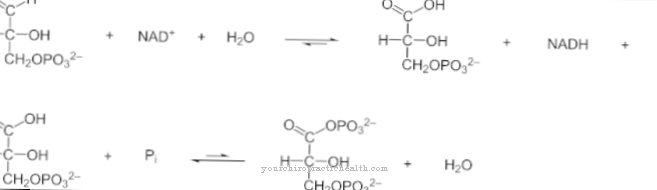
Methion kan relatief gemakkelijk de bloed-hersenbarrière passeren en is betrokken bij de vorming van de myeline-omhulsels van de zenuwen - ook in het CZS. Overtollige methionine die niet direct nodig is, kan worden omgezet in S-adenosylmethionine (SAM) door toe te voegen aan ATP (adenosinetrifosfaat) en kan optreden als een methylgroepdonor (-CH3). Na het vrijkomen van de methylgroep kan de methionine weer worden gerecycled en is het beschikbaar voor verdere metabolische processen. Overtollige methionine kan in verschillende stadia tot op zekere hoogte worden afgebroken en gemetaboliseerd.
Extra doses methionine leiden via het fysiologische afbraakproces tot een opzettelijke verzuring van de urine, die bij urineweginfecties de bacteriegroei remt en de werking van de toegediende antibiotica ondersteunt. Ook calciumfosfaat- en magnesiumammoniumfosfaatstenen kunnen door de lage pH van de urine weer oplossen.
Opleiding, voorkomen, eigenschappen en optimale waarden
Methionine is een essentieel aminozuur, dus het moet van buitenaf via voedsel worden aangevoerd. Veel voedingsmiddelen, zowel van dierlijke als van plantaardige oorsprong, bevatten methionine, maar niet in vrije vorm, maar altijd eiwitgebonden.
Voedingsmiddelen met aanzienlijke hoeveelheden gebonden methionine zijn z. B. rauw rundvlees, rauwe zalm, sesamzaadjes, gedroogde sojabonen en vele andere voedingsmiddelen, waaronder plantaardig voedsel. Met meer dan 1.000 mg methionine per 100 gram hebben paranoten zelfs een bijna twee keer zo hoog gehalte als rauwe zalm. De eiwitten worden in de dunne darm verteerd. De eiwitten worden door gespecialiseerde peptidasen grotendeels in kleinere stukjes (polypeptiden) afgebroken en via de dunne darmvlokken opgenomen.
Bij een uitgebalanceerd dieet kan worden aangenomen dat er voldoende methionine wordt geconsumeerd. De indicaties voor optimale hoeveelheden variëren een beetje. Als referentiewaarde kan worden uitgegaan van een menselijke behoefte van ca. 13 tot 16 mg per kilogram lichaamsgewicht. Een persoon met een normaal gewicht met een lichaamsgewicht van 75 kg is daarom afhankelijk van een dagelijkse inname van methionine in de orde van grootte van 975 tot 1.200 mg.
Uw medicatie vindt u hier
➔ Geneesmiddelen tegen spierzwakteZiekten en aandoeningen
Het essentiële aminozuur methionine dient als uitgangsmateriaal voor tal van complexe stofwisselingsprocessen, zodat verstoringen van bepaalde omzettingsprocessen door het ontbreken van bepaalde enzymen tot soms ernstige symptomen kunnen leiden. Een tekort aan methionine leidt ook tot een tekort aan S-adenosyl methionine (SAM).
Het ontbreken van SAM houdt onder meer verband met het ontstaan van leververvetting en het bevorderen van depressie. Sommige verstoringen in het methionine-cysteïne metabolisme, die worden veroorzaakt door een tekort aan bepaalde enzymen, leiden tot een overmatige accumulatie van het tussenproduct homocysteïne. De bekendste oorzaak van homocystinurie, zoals de accumulatie van homocysteïne wordt genoemd, is een genetisch defect dat een tekort aan cystathionine-bèta-synthase veroorzaakt.
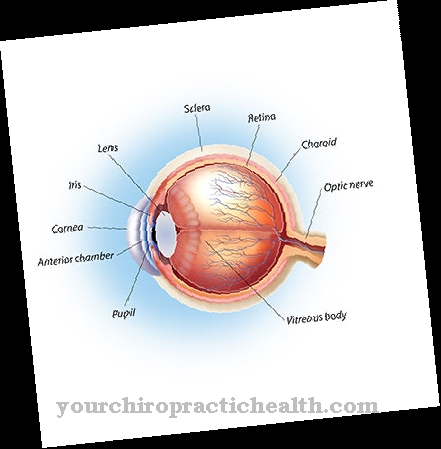
Het teveel aan homocysteïne bevordert de vorming van trombose en heeft een negatief effect op het bindweefsel, vooral op het skelet en de ogen, waardoor het risico bestaat dat de ooglenzen van positie veranderen (lens-ectopie). Homocystinurie beïnvloedt ook mentale processen. Wanneer de methionine stofwisselingsstoornis leidt tot een tekort aan cysteïne, treedt ook een tekort aan glutathion en taurine op, die belangrijke beschermende functies op de zenuwen hebben. Er is een verband vastgesteld tussen cysteïne-deficiëntie en de progressie van de ziekte van Alzheimer en de ziekte van Parkinson.



.jpg)

.jpg)
.jpg)


.jpg)