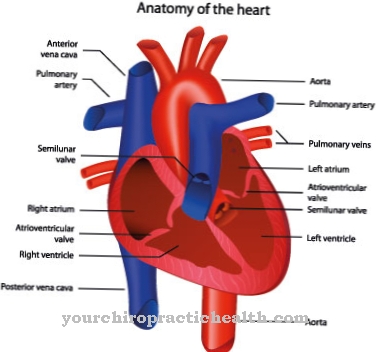
Net zo Plasma-eiwitten worden de eiwitten van het bloedplasma genoemd. Ze verschillen van serumeiwitten voornamelijk in de stollingsfactoren. De plasmaproteïnen nemen talrijke taken op zich in het organisme en kunnen in de context van verschillende ziekten worden beïnvloed door deficiëntieverschijnselen.
Wat zijn plasma-eiwitten?
De medische professional begrijpt de plasma-eiwitten als de eiwitten van het bloedplasma, ook wel bekend als Bloed proteïne zijn aangewezen. Plasma verschilt van bloedserum in zijn stollingsfactoren, die ook plasma-eiwitten zijn. In totaal zijn er ongeveer honderd verschillende eiwitten en glycoproteïnen in het bloedplasma. De eiwitten vormen ongeveer zes tot acht gram per 100 milliliter bloedplasma. De term serumeiwit moet worden onderscheiden van plasma-eiwitten.
Serumeiwitten zijn alle bloedeiwitten minus de stollingsfactor fibrinogeen. De plasma-eiwitten kunnen via elektroforese worden opgesplitst in albuminen en globulines. Dit betekent dat de eiwitten in het bloedplasma, als geladen colloïdale delen of moleculen, zich splitsen in albuminen en globulines terwijl ze door een elektrisch veld migreren. Deze twee groepen zijn in het plasma aanwezig in een verhouding van ongeveer 40 tot 60 procent.
Anatomie en structuur
Globulines zijn α1-, α2-, γ- of β-globulines. De elektroforetische mobiliteit van deze vier subgroepen is hun belangrijkste onderscheidende kenmerk. Naast circa vier procent α1-globulines bevat het plasma ook circa acht procent α2-globulines en twaalf procent β-globulines. De γ-globulines vormen met 16 procent het grootste deel van het bloedplasma. De biosynthese van plasma-eiwitten vindt voornamelijk plaats in de lever en in de lymfe.
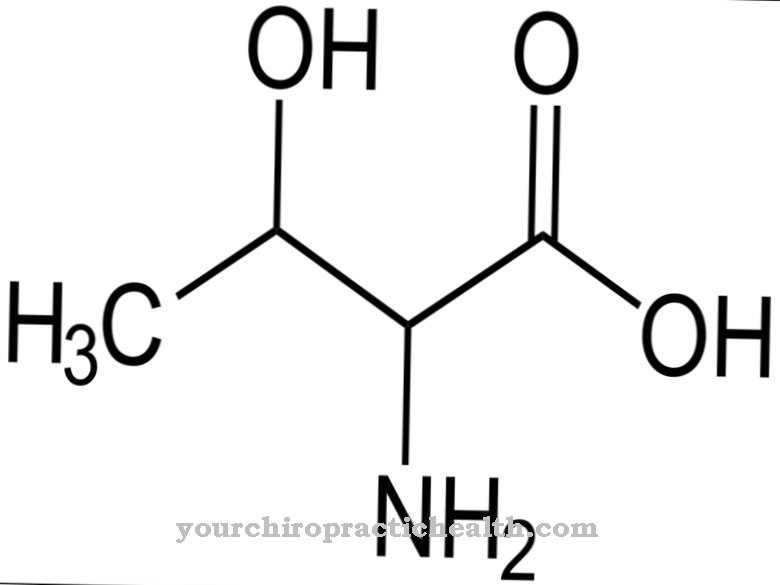
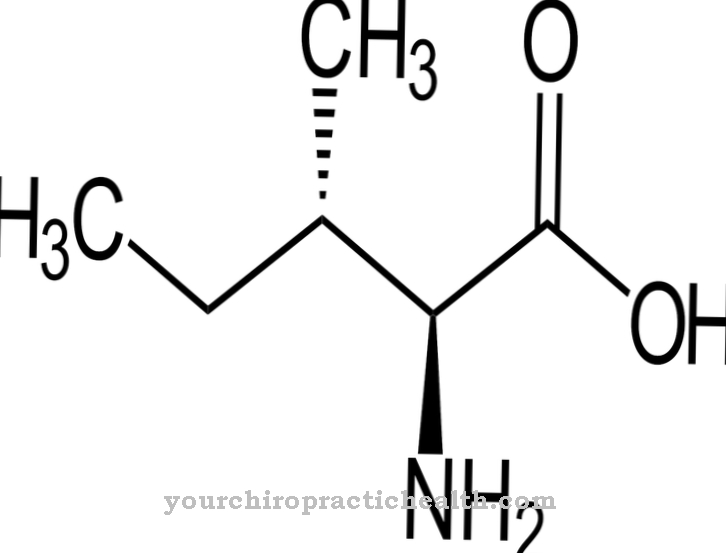
In het geval van glycoproteïnen vindt vertaling plaats via posttranslationele modificatie. Glycosylresten binden aan nucleosidedifosfaat in hun actieve vorm. Ze binden glycosyltransferases aan eiwitten. Zoals alle eiwitten zijn plasma-eiwitten biologische macromoleculen die zijn opgebouwd uit aminozuren. Globulaire eiwitten zijn bijna bolvormig in quaternaire of tertiaire structuur. Meer dan 100 aminozuren zijn gekoppeld om ketens in eiwitten te vormen. De eiwitten in het bloedplasma worden ook wel sferoïde-eiwitten genoemd. Ze kunnen gemakkelijk worden opgelost in water en zoutoplossing.
Functie en taken
Plasma-eiwitten nemen verschillende taken op zich in het menselijk lichaam. Enerzijds handhaven ze de colloïde osmotische druk, die op zijn beurt weer een rol speelt bij het handhaven van het plasmavolume. De pH van het bloed wordt ook op peil gehouden door plasma-eiwitten. Afgezien daarvan heeft het bloedeiwit een transportfunctie. Ze transporteren in water onoplosbare stoffen door het lichaam en worden daarom ook wel dragerproteïnen genoemd.
Ook het transport van hormonen en enzymen vindt plaats op dragereiwitten van het bloedplasma. Plasma-eiwitten zoals fibrinogeen, die helpen bij homeostase, zijn met name onmisbaar voor bloedstolling. Daarnaast nemen plasma-eiwitten belangrijke taken op zich bij processen van het immuunsysteem, bijvoorbeeld bij ontstekingen. In dit verband spreken we ook van immunoglobulinen of antilichamen die worden gevormd als reactie op antigenen. Immunoglobulinen herkennen vreemde lichamen en binden zich aan deze antigenen om ze te vernietigen. De α1-globulines omvatten voornamelijk transcortine, dat verantwoordelijk is voor het transport van steroïden. Het α1-antitrypsine remt protease. Hetzelfde geldt voor α1-antichymotrypsine. Het plasma-eiwit HDL is een dragereiwit voor bloedlipiden.
Protrombine werkt als een pro-enzym van trombine en transcobalamine transporteert cobalamine door de bloedbaan. De α2-globulines omvatten haptoglobine, dat hemoglobine bindt en transporteert. α2-macroglobuline en α2-antitrombine remmen de bloedstolling, terwijl ceruloplasmine koper transporteert. Transferrine, dat verantwoordelijk is voor het transport van ijzer, is een van de β-globulines. β-lipoproteïne transporteert bloedlipiden, terwijl fibrinogeen bekend staat als een bloedstollingsfactor. Hemopexin is een laatste β-globuline en bindt vrij heem. De immunoglobulinen behoren tot de vijfde globulinegroep, waarvan de componenten ook wel γ-globulinen worden genoemd.
Ziekten
Bij dysproteïnemie zijn er verschuivingen in de kwantitatieve verhouding van bloedeiwitten. Dit fenomeen kan zowel aangeboren als verworven zijn. Verworven dysproteïnemie kan bijvoorbeeld worden veroorzaakt door acute infecties. In dit geval neemt het aandeel albuminen af en neemt het aandeel globulinen toe. Dit fenomeen kan ook optreden bij groot bloedverlies of na een operatie. Er moet onderscheid worden gemaakt tussen deze verworven vormen van dysproteïnemie, een aangeboren maldistributie, zoals het geval is bij alfa-1-antitrypsinedeficiëntie.
Door een genetisch defect wordt te weinig alfa-1-antitrypsine aangemaakt. Bij een genetisch tekort aan individuele plasma-eiwitten hebben we het ook over defecte proteïnemie. Er moet een onderscheid worden gemaakt tussen dit en paraproteïnemie. Als onderdeel van deze ziekte worden in toenemende mate bepaalde immunoglobulinen of ketens van immunoglobulinen gevormd. Dergelijke processen vinden bijvoorbeeld plaats in de context van de ziekte van Waldenström. Dit is een kwaadaardige lymfoomziekte waarbij de lymfoomcellen het immunoglobuline M. Er is ook een overconcentratie van immunoglobulinen bij multipel myeloom. Bij deze kanker van het beenmerg vermenigvuldigen de antilichaamproducerende cellen zich in het bloedplasma.
Deze gedegenereerde plasmacellen produceren een overmaat aan antilichamen of antilichaamfragmenten. In verband met de plasmaproteïnen kunnen zowel hypoproteïnemie als hyperproteïnemie optreden. In het eerste geval zakt de concentratie van plasmaproteïnen onder de 66 gram per liter. Bij hyperproteïnemie daarentegen is de concentratie meer dan 83 gram per liter. De oorzaak van hypoproteïnemie kan bijvoorbeeld leverschade of ondervoeding zijn. Hyperproteïnemie daarentegen wordt meestal geassocieerd met ontstekingsprocessen en kan bijvoorbeeld optreden in de context van tuberculose.

.jpg)



.jpg)