De Transfer RNA is een RNA met een korte keten, dat is samengesteld uit 70 tot 95 nucleobasen en, in tweedimensionale weergave, een klaverachtige structuur heeft met 3 tot 4 lussen.
Voor elk van de 20 bekende proteïnogene aminozuren is er minstens 1 transfer-RNA dat ‘zijn’ aminozuur uit het cytosol kan opnemen en beschikbaar kan maken voor de biosynthese van een proteïne op een ribosoom van het endoplasmatisch reticulum.
Wat is Transfer RNA?
Het transfer-RNA, internationaal bekend als tRNA afgekort, bestaat uit ongeveer 75 tot 95 nucleobasen en doet in het tweedimensionale bovenaanzicht denken aan een klaverbladachtige structuur met drie vaste en één variabele lus en de aminozuuracceptorstam.
In de driedimensionale tertiaire structuur lijkt een tRNA-molecuul meer op een L-vorm, waarbij het korte been overeenkomt met de acceptorstam en het lange been met de anticodonlus. Naast de vier onveranderde nucleosiden adenosine, uridine, cytidine en guanosine, die tevens de basisbouwstenen vormen van DNA en RNA, bestaat een deel van het tRNA uit in totaal zes gemodificeerde nucleosiden die geen deel uitmaken van DNA en RNA. De aanvullende nucleosiden zijn dihydrouridine, inosine, thiouridine, pseudouridine, N4-acetylcytidine en ribothymidine.
In elke tak van het tRNA vormen zich conjugerende nucleobasen met dubbelstrengige secties analoog aan DNA. Elk tRNA kan slechts een bepaald van de 20 bekende proteïnogene aminozuren opnemen en naar het ruwe endoplasmatisch reticulum transporteren voor biosynthese en daar beschikbaar maken. Dienovereenkomstig moet er ten minste één gespecialiseerd transfer-RNA beschikbaar zijn voor elk proteïnogeen aminozuur. In werkelijkheid is er voor bepaalde aminozuren meer dan één tRNA beschikbaar.
Functie, effect en taken
De hoofdtaak van het transfer-RNA is om een specifiek proteïnogeen aminozuur uit het cytosol aan zijn aminozuuracceptor te laten koppelen, het naar het endoplasmatisch reticulum te transporteren en daar via een peptidebinding aan de carboxygroep van het laatst afgezette aminozuur te hechten, zodat het gevormde eiwit kan worden gehecht. verlengd met één aminozuur.
Het volgende tRNA is dan weer klaar om het "juiste" aminozuur volgens de codering op te slaan. De processen verlopen met hoge snelheid. In eukaryoten, inclusief menselijke cellen, worden de polypeptideketens tijdens de eiwitsynthese met ongeveer 2 aminozuren per seconde verlengd. Het gemiddelde foutenpercentage is ongeveer één aminozuur per duizend. Dit betekent dat bij de eiwitsynthese ongeveer elk duizendste aminozuur verkeerd is gesorteerd. Het is duidelijk dat dit foutenpercentage in de loop van de evolutie is afgevlakt als het beste compromis tussen het noodzakelijke energieverbruik en mogelijke negatieve fouteffecten.
Het proces van eiwitsynthese vindt plaats in bijna alle cellen tijdens de groei en om de rest van het metabolisme te ondersteunen. Het tRNA kan zijn belangrijke taak en functie van het selecteren en transporteren van bepaalde aminozuren alleen vervullen als het mRNA (boodschapper-RNA) kopieën heeft gemaakt van de overeenkomstige gensegmenten van het DNA. Elk aminozuur wordt in principe gecodeerd door de sequentie van drie nucleïnezuurbasen, het codon of triplet, zodat de vier mogelijke nucleïnezuurbasen wiskundig 4 tot de macht 3 gelijk zijn aan 64 mogelijkheden. Aangezien er echter slechts 20 proteïnogene aminozuren zijn, kunnen sommige tripletten worden gebruikt voor controle als start- of eindcodons. Sommige aminozuren worden ook gecodeerd door verschillende tripletten.
Dit heeft als voordeel dat een bepaalde fouttolerantie ten opzichte van puntmutaties wordt bereikt, omdat ofwel de verkeerde sequentie van het codon toevallig voor hetzelfde aminozuur codeert, ofwel omdat een aminozuur met vergelijkbare eigenschappen in het eiwit is opgenomen, zodat het gesynthetiseerde eiwit in veel gevallen uiteindelijk foutvrij is. of de functionaliteit is slechts een beetje beperkt.
Opleiding, voorkomen, eigenschappen en optimale waarden
Transfer-RNA's zijn in bijna alle cellen aanwezig in verschillende hoeveelheden en verschillende samenstellingen. Ze zijn gecodeerd zoals andere eiwitten. Verschillende genen zijn verantwoordelijk voor de blauwdrukken van de individuele tRNA's. De verantwoordelijke genen worden getranscribeerd in de celkern in het caryoplasma, waar ook de zogenaamde precursors of pre-tRNA's worden gesynthetiseerd voordat ze door het kernmembraan naar het cytosol worden getransporteerd.
Alleen in het cytosol van de cel bevinden de pre-tRNA's, door het afsplitsen van zogenaamde introns, basesequenties die geen functie hebben op de genen en alleen worden meegenomen, maar toch worden getranscribeerd. Na verdere activeringsstappen is het tRNA beschikbaar voor het transport van een bepaald aminozuur. Mitochondriën spelen een speciale rol omdat ze hun eigen RNA hebben, dat ook genen bevat die genetisch tRNA's definiëren voor hun eigen behoeften. De mitochondriale tRNA's worden intramitochondriaal gesynthetiseerd.
Vanwege de bijna universele deelname van verschillende transfer-RNA's aan eiwitsynthese en vanwege hun snelle conversie, kunnen geen optimale concentratiewaarden of referentiewaarden met boven- en ondergrenzen worden gegeven. De beschikbaarheid van overeenkomstige aminozuren in het cytosol en andere enzymen die tRNA's kunnen activeren, is belangrijk voor de functie van de tRNA's.
Ziekten en aandoeningen
De grootste gevaren voor een verstoring van de functie van het transfer-RNA liggen in een gebrek aan aanvoer van aminozuren, vooral een gebrek aan essentiële aminozuren, die het lichaam niet kan compenseren met andere aminozuren of met andere stoffen.
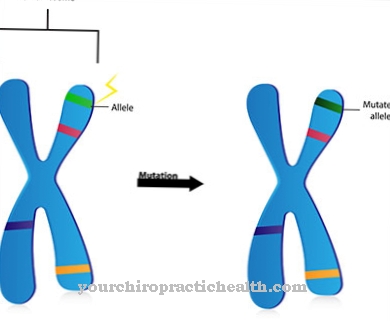
Wat betreft echte verstoringen in de functie van de tRNA's, schuilt het grootste gevaar in genmutaties, die op bepaalde punten in de verwerking van het transfer-RNA ingrijpen en in het ergste geval leiden tot een functioneel falen van het overeenkomstige tRNA-molecuul. Thalassemie, een anemie die wordt toegeschreven aan een genmutatie in intron 1, dient als voorbeeld. Een genmutatie in het gen dat codeert voor intron 2 leidt ook tot hetzelfde symptoom. Als gevolg hiervan wordt de hemoglobinesynthese in de erytrocyten ernstig beperkt, zodat een onvoldoende toevoer van zuurstof optreedt.





.jpg)
.jpg)

.jpg)


.jpg)