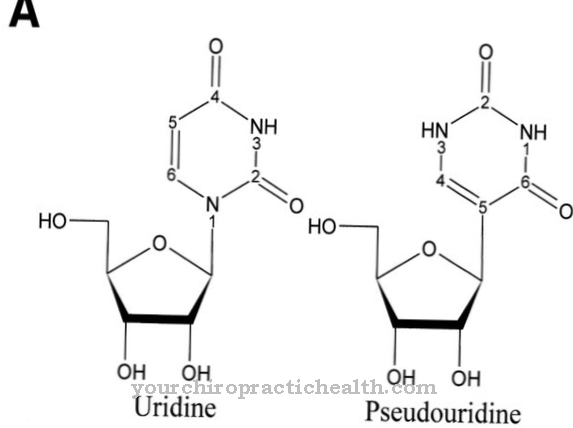
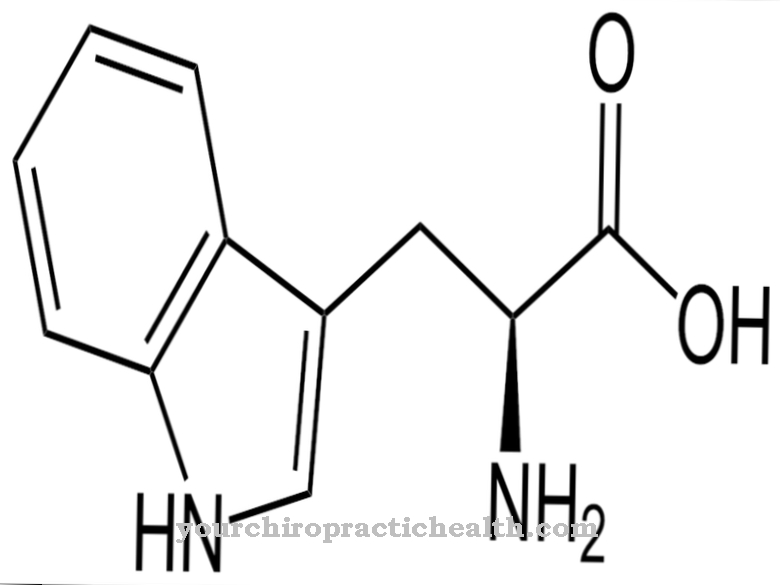
Desmosin is een proteïnogeen aminozuur. Samen met andere aminozuren vormt het de vezel en het structurele eiwit elastine. Bij mutaties in het ELN-gen wordt de structuur van het elastine verstoord.
Wat is desmosin?
Aminozuren zijn een belangrijk onderdeel van het menselijk organisme. Ze zijn een klasse van organische verbindingen die worden gevormd uit ten minste één carboxygroep en één aminogroep. Aminozuren zijn dus zowel carbonzuren als aminen.
Afhankelijk van hun positie ten opzichte van de carboxygroep, kunnen aminozuren aan verschillende groepen worden toegewezen. Aminozuren met een terminale carboxygroep worden geminal of α genoemd en behoren tot de α-aminozuren. Deze aminozuren zijn elementen van eiwitten. Het menselijk lichaam heeft meer dan 20 proteïnogene aminozuren en 400 niet-proteïnogene aminozuren. De D-aminozuren vormen een bijzondere groep. Een van de meer dan 20 proteïnogene aminozuren is desmosine, dat samen met het gelijkaardige opgebouwde isodesmosine het vezeleiwit elastine vormt.
Het elastine en zijn oplosbare precursor tropo-elastine behoren tot de structurele eiwitten en dragen bij tot de vorming en het behoud van anatomische structuren. Elastine speelt een bijzondere rol bij het vermogen van grote bloedvaten om uit te rekken, bijvoorbeeld de aorta.
Functie, effect en taken
Desmosin is formeel een viervoudig aminozuur. Het heeft een pyridiniumring in het midden. Pyridine is een chemische verbinding met de empirische formule C5H5N, die kan worden toegewezen aan de heterocyclische oudersystemen en vormt het eenvoudigste azine in de vorm van een zesring met één stikstofatoom en vijf koolstofatomen.
Dankzij de centrale pyridiniumring kan desmosin de afzonderlijke eiwitstrengen in het vezeleiwit elastine netwerken. De samenstelling van elastine is vergelijkbaar met die van collageen. In plaats van hydroxylysine heeft elastine echter een aanzienlijk aandeel valine. Lysineresten worden geoxideerd tot allysine door het enzym lysyloxidase. Drie allysines en één lysine vormen op hun beurt een desmosine in de vorm van een ring. Deze vorm speelt een belangrijke rol bij de elasticiteit van een volledig elastinemolecuul.
Als eiwitnetwerk bestaat elastine uit aan desmosine gekoppelde eenheden en is elastisch rekbaar. Zowel de longen als de huid en bloedvaten zijn afhankelijk van elastine en het bestanddeel desmosine, omdat dit de enige manier is waarop ze hun aanzienlijke elasticiteit verkrijgen. Desmosin fluoresceert blauw onder UV-licht en geeft elastine zijn gele kleur, zijn onoplosbaarheid in water, hittestabiliteit en weerstand tegen basen en proteasen.
Opleiding, voorkomen, eigenschappen en optimale waarden
De vorming van desmosine wordt ook wel de biosynthese van desmosine genoemd. Tijdens deze biosynthese worden de terminale aminogroepen van L-lysine-eenheden door het enzym lysyloxidase door oxidatie omgezet in ω-aldehyden.
Lysyloxidase is een eiwit lysine 6 oxidase en komt dus overeen met een enzym dat voorkomt in de extracellulaire ruimte van het bindweefsel. Bij de verknoping van elastine en collageen dient het als katalysator en mechanische stabilisator voor eiwitten. Tijdens de biosynthese van desmosine zet het lysyloxidase lysine om in allysine. Dit proces vindt plaats in de extracellulaire matrix en stabiliseert de kruisverbindingen tussen collageen en elastine. Chemisch gezien komt de reactie overeen met oxidatieve deaminering om het aldehyde te vormen. Allysine vormt ofwel allysinaldol of desmosine met aldehydresiduen van naburige tropelastinemoleculen door middel van een aldolcondensatie.
Overgebleven lysine vormt een Schiff-base via zijn aminogroep en creëert isodesmosine. Naast de bloedvaten, de longen en de huid, dragen met name alle microfibrillen desmosin. Dit zijn de kleinste vezels van collageen, reticulair en elastisch weefsel.
Ziekten en aandoeningen
De vorming van elastine uit componenten zoals desmosine wordt bij verschillende ziekten verstoord. Deze ziekten omvatten voornamelijk mutaties in het ELN-gen. De belangrijkste hiervan zijn dermatochalasis, Williams-Beuren-syndroom en subvalvulaire congenitale aortastenose. Dermatochalasis is een groep bindweefselveranderingen met familiale accumulatie.
Kenmerkend voor deze groep is de slappe, minder elastische en gerimpelde huid op verschillende delen van het lichaam. Het ELN-gen codeert voor elastine en kan via een mutatie dergelijke symptomen veroorzaken. Het Williams-Beuren-syndroom is in vergelijking hiermee vrij zeldzaam en treft slechts één op de 20.000 pasgeborenen. De ziekte wordt veroorzaakt door een defect op chromosoom zeven. De genlocus is 7q11.23. Door een defect op dit punt mist de getroffen persoon het elastine-gen en aangrenzende genen. De verwijdering van het elastine-gen veroorzaakt dysmorfisme in het gezicht en stoornissen in de interne orgaanstructuur. Hartafwijkingen zoals supravalvulaire aortastenose en niermisvormingen zoals de hoefijzernier of renale vasculaire stenose kunnen het gevolg zijn. Daarnaast is er vaak sprake van een cognitieve beperking.
De mentale vermogens van de getroffenen zijn onder het gemiddelde. Ondanks verbale expressiviteit vormen ze meestal zinnen met weinig inhoud. Ze beginnen met lezen op zeer jonge leeftijd, waardoor hun mentale vermogens vaak worden overschat. Naast hun hyperlexie leidt hun perfecte toonhoogte vaak tot overschattingen. Als een vorm van elastinemutatie komt subvalvulaire congenitale aortastenose op zijn beurt overeen met een hartafwijking die gepaard gaat met een vernauwing van de hoofdslagader. De supravalvulaire stenose ligt over de aortaklep aan het begin van de aorta.
Deze vorm van het hartdefect wordt vaak gekenmerkt door zandlopervormige vernauwingen die boven de uitlaat van de coronaire vaten liggen. Het opgaande deel van de aorta kan ook worden versmald. Deze vorm van aortastenose komt vooral vaak voor in de context van het zojuist besproken Williams-Beuren-syndroom. Dit hartafwijking is al waargenomen, ongeacht de ziekte. In dit geval hoeft het echter niet per se verband te houden met een mutatie in het elastine-gen.



.jpg)

.jpg)
.jpg)


.jpg)