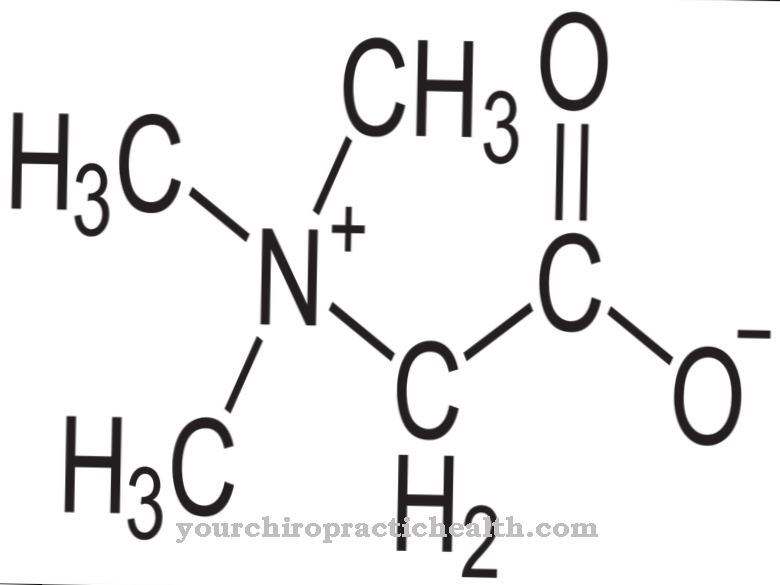
Oxaalzuur, ook gekend als Ethaandizuur of Klaver zuur, is de eenvoudigste vorm van dicarbonzuur. De formule C2H2O4 is een kristallijne vaste stof die kleurloos en geurloos is. De fysische toestand van oxaalzuur is vast.
Wat is oxaalzuur?
Als reductiemiddel wordt oxaalzuur bepaald door titratie met oxidatiemiddelen zoals kaliumpermanganaat. Dit proces produceert kooldioxide als oxidatieproduct. De zouten van oxaalzuur zijn bekend onder de systematische naam ethaandioaat, oxalaat.
Oxaalzuur werd al in 1769 ontdekt. Johann Christian Wiegleb ontdekte dit zuur in klaverzuring als het kaliumzout. Afgeleid van klaverzuring, werd de historische naam Kleesäure daarom in taalgebruik behouden. In 1776 slaagden Carl Wilhelm Scheele en Torbern Olof Bergman erin oxaalzuur te produceren door suiker samen met salpeterzuur te oxideren. Dit proces is echter geen synthese, maar alleen de afbraak van een natuurlijke stof. De kunstmatige productie van oxaalzuur lukte voor het eerst in 1824. Friedrich Wöhler synthetiseerde oxaalzuur door verzeping van dicyaan uit anorganische grondstoffen.
Functie, effect en taken
Oxaalzuur is ideaal voor het verwijderen van roestvlekken en wordt ook gebruikt als bleekmiddel. Imkers gebruiken oxaalzuur, vooral in de winter, om de varroamijt te bestrijden. De suikeroplossing van 3,5 procent, die erg waterig is, wordt op bijen gesproeid of gedruppeld.
Imkers die varroose behandelen met oxaalzuur lopen echter risico door direct contact met het zuur. Oxaalzuur wordt in het laboratorium ook gebruikt als basische titerstof voor manganometrie, omdat hiervoor het dihydraat van oxaalzuur kan worden gebruikt. Oxaalzuur is ook geschikt als basische titersubstantie voor de nauwkeurige bepaling van het gehalte aan alkalische standaardoplossingen zoals natriumhydroxideoplossing. Vanwege de vorming van een slecht oplosbaar calciumzout, is oxaalzuur nuttig voor de gravimetrische bepaling van een calciumion als calciumoxalaat.
Oxaalzuur, dat wordt verkregen uit de klaverzuring van het Fichtelgebergte, wordt ook gebruikt voor het effectief bleken van kwarts, d.w.z. bergkristal, waarvan het voorkomen met name onder de stad Weißenstadt is bewezen. Oxaalzuur ondersteunt het glanzend polijsten van marmer en wordt in de houtverwerkende industrie gebruikt als een mild bleekmiddel. Het verwijdert vlekken die reactief zijn ontstaan als reactie van looizuren of door contact met looizuurhoudend hout met ijzeren gereedschappen. Farmaceutische chemie profiteert van het effect van oxaalzuur door zijn eigenschap als zoutvormer.
De protonering van basische aminen levert zogenaamde oxalaten op. Oxaalzuur wordt ook in zeer kleine hoeveelheden aangetroffen in zwarte thee, pepermuntthee en in de wortels en schors van veel planten als onoplosbare calciumoxalaten. Oxaalzuur is in kleine hoeveelheden niet schadelijk voor de gezondheid, maar wel in hogere concentraties. Calciumoxalaten worden in de natuur vaak geproduceerd door de dood van plantencellen. Nierstenen bestaan ook uit dit calciumoxalaat en urinezuur, maar de vorming van nierstenen wordt voorkomen door fruit te eten dat citroenzuur bevat.
Opleiding, voorkomen, eigenschappen en optimale waarden
Oxaalzuur en kaliumzout worden in grote hoeveelheden aangetroffen in duizendknoopplanten zoals rabarber, die ongeveer 180 tot 765 milligram per 100 gram vers gewicht en stengels kunnen bevatten. Bij zuring wordt het meeste oxaalzuur in de bladeren aangetroffen.
Stervruchten bevatten tussen de 40 en 1000 milligram per 100 gram verse substantie, vergelijkbaar met klaverzuring. Snijbiet bevat tussen de 110 en 940 milligram per 100 gram vers gewicht. Spinazie bevat 120 tot 1330 milligram, terwijl peterselie bij 100 gram versgewicht slechts 185 milligram bevat. Oxaalzuur en zijn kaliumzout worden ook aangetroffen in cacao met 338 tot 480 milligram in 100 gram en in chocolade met 80 tot 200 milligram. 100 gram verse bieten bevat tussen de 17 en 329 milligram.
Veel schimmels scheiden oxaalzuur af, dat wordt bevorderd door de productie van een alkalische reactie in de voedingsoplossing. Oxaalzuur wordt verkregen door natriumformiaat snel te verwarmen tot 360 graden Celsius. Wereldwijd wordt jaarlijks ongeveer 140.000 ton oxaalzuur inclusief esters geproduceerd. Het sterke zuur breekt af bij temperaturen boven de 150 graden Celsius onder vorming van kooldioxide, koolmonoxide en water.
Ziekten en aandoeningen
Oxaalzuur verstoort de opname van ijzer in de darmen, daarom moet u de consumptie van voedingsmiddelen met oxaalzuur verminderen. Calcium kan in het aangetaste weefsel worden verminderd, wat in het ergste geval het hart kan beschadigen.
Over het algemeen leidt zelfs een kleine vergiftiging als gevolg van geblokkeerde niertubuli tot nierbeschadiging. Regelmatig direct contact met oxaalzuur kan gezondheidsrisico's opleveren, zoals voor imkers die oxaalzuur gebruiken om varroose te bestrijden. Hoewel oxaalzuur een slechte reputatie heeft in verband met voeding, wordt aangenomen dat het zuur positieve eigenschappen heeft in de afweer tegen ziektes zoals tegen aflatoxinen en Aspergillus.
Het is bewezen dat een te hoge oxalaatwaarde een negatief effect heeft op het menselijk organisme, omdat het stoffen vermindert die belangrijk zijn voor het lichaam zoals magnesium, zink, kalium en calcium. De consumptie van oxaalzuur in de voeding mag in geringe mate geen schadelijke effecten hebben, aangezien verschillende soorten groenten zoals snijbiet, rabarber of zuring gezond zijn. Met mate hebben voedingsmiddelen met een hoog gehalte aan oxalaten en oxaalzuur gezonde effecten, zoals spinazie of matige consumptie van thee heeft zeker positieve effecten.


.jpg)




.jpg)