Cobalaminen vertegenwoordigen chemische verbindingen die tot de vitamine B12-groep behoren. Ze komen in alle organismen voor. Ze worden alleen door bacteriën aangemaakt.
Wat zijn cobalaminen?
Cobalaminen zijn een groep chemische verbindingen met dezelfde basisstructuur die behoren tot het vitamine B12-complex. Het is een complexe verbinding met kobalt als het centrale atoom. Het zijn tot nu toe de enige bekende natuurlijke stoffen die kobalt bevatten.
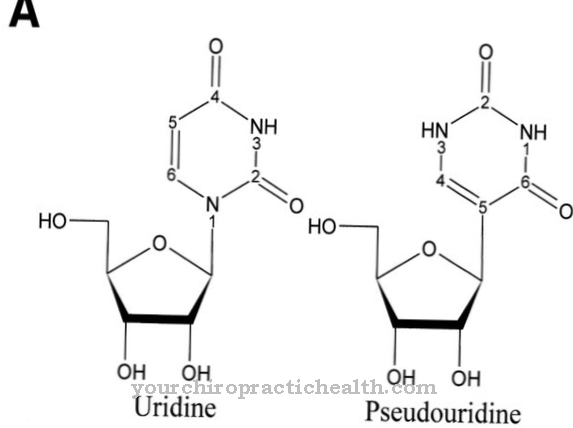
Het kobaltatoom is omgeven door in totaal zes liganden. Vier liganden vertegenwoordigen elk een stikstofatoom van een planair corrin-ringsysteem Het vijfde stikstofatoom behoort tot een 5,6-dimethylbenzimidazoolring, die op nucleotidevorm aan de corrinering is gebonden. Een zesde ligand is heel gemakkelijk te binden en uitwisselbaar. Alleen deze uitwisselbare ligand kenmerkt de specifieke aanwezige verbinding. De eigenlijke vitamine B12 bevat een cyaanresidu als zesde ligand en wordt daarom cyanocobalamine genoemd.
Andere belangrijke cobalaminen zijn onder meer aquacobalamine (vitamine B12a), hydroxycobalamine (vitamine B12b), nitritocobalamine (vitamine B12c), methylcobalamine (methyl-B12, MeCbl) en, als uiterst belangrijk co-enzym, adenosylcobalamine (co-enzym B12). Al deze verbindingen vertegenwoordigen ook bewaarvormen van vitamine B12. Cyanocobalmin is de enige vitamine B12 die in de geneeskunde kan worden gebruikt. Het wordt onmiddellijk in het lichaam omgezet in co-enzym B12.
Alle bewaarvormen van het actieve ingrediënt worden via de voeding opgenomen. De vitamine B12 die door bacteriën in de dikke darm wordt aangemaakt, kan niet door mensen worden gebruikt omdat de opname van cobalamine in de dunne darm plaatsvindt.
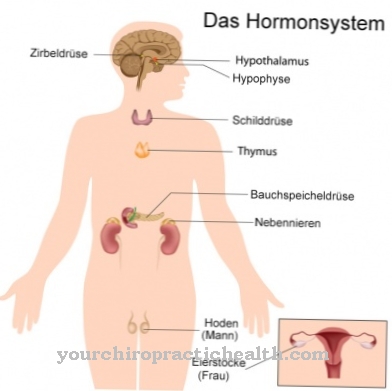
Functie, effect en taken
Vitamine B12 vervult belangrijke functies bij de bloedvorming, celdeling en in het zenuwstelsel. Het neemt slechts deel aan twee enzymatische reacties in het organisme, maar ze zijn van centraal biologisch belang.
Het enzym N5-methyl-tetrahydrofolaat-homocysteïne-S-methyltransferase (methioninesynthase) fungeert als methylgroepdonor met behulp van co-enzym B12. Methioninesynthase reactiveert enerzijds de methylgroepdrager S-adenosylmethionine (SAM) en hermethyleert anderzijds homocysteïne tot methionine. Als er een tekort of falen van vitamine B12 is, hoopt homocysteïne zich op in het bloed. Verhoogde homocysteïneconcentraties vormen een risicofactor voor arteriosclerose Verder hoopt het enzym N5-methyl-THF zich op en zorgt zo voor een secundair tekort aan THF (tetrahydrofoliumzuur).
THF ondersteunt de structuur van de purinebasen adenine en guanine, evenals de pyrimidinebase thymine. De stikstofbasen zijn betrokken bij de constructie van de nucleïnezuren DNA en RNA. Als THF ontbreekt, wordt de nucleïnezuursynthese verstoord. De tweede functie van vitamine B12 is het ondersteunen van het enzym methylmalonyl-CoA-mutase. De methylmalonyl-CoA-mutase breekt oneven vetzuren af onder vorming van propionyl-CoA's. Propionyl-CoAs wordt vervolgens geïntroduceerd in de citroenzuurcyclus. Een metaboliet in dit proces is methylmalonyl-CoA. Als vitamine B12 ontbreekt, hoopt methylmalonyl-CoA zich op, wat vervolgens kan leiden tot neurologische symptomen.
Opleiding, voorkomen, eigenschappen en optimale waarden
Cobalaminen kunnen niet worden geproduceerd in het metabolisme van planten, dieren of mensen. Slechts een paar bacteriën zijn in staat om dit actieve ingrediënt te synthetiseren. Dit omvat ook menselijke darmbacteriën.
Omdat cobalamine-synthese bij mensen plaatsvindt in de dikke darm, maar de opname van vitamine B12 in de dunne darm plaatsvindt met behulp van de intrinsieke factor, kan de in de darm gevormde cobalamine niet worden gebruikt. Mensen zijn afhankelijk van voedselvoorraden. Tegelijkertijd is er een biochemisch proces waardoor vitamine B12 door middel van galzuren herhaaldelijk terug naar de dunne darm kan worden getransporteerd, waar het opnieuw wordt opgenomen. Dit betekent dat als het reservoir in de lever eenmaal is gevuld, het meerdere jaren meegaat, ook als er geen aanvoer van vitamine B12 is. De lever kan 2.000 tot 5.000 microgram cobalamine opslaan.
De minimale dagelijkse behoefte voor volwassenen is ongeveer 3 microgram. De behoefte aan kinderen is lager en neemt in de loop van de tijd toe. Zwangere vrouwen en vrouwen die borstvoeding geven hebben een hogere behoefte, namelijk 3,5 tot 4 microgram per dag. Na 450 tot 750 dagen is de helft van de bestaande cobalamine opgebruikt. Belangrijke bronnen van cobalamine zijn de lever en ingewanden van verschillende boerderijdieren, haring, rundvlees, kaas, kippeneieren en tonijn. Vitamine B12 komt vrijwel niet voor in plantaardig voedsel. Bij een vegetarische levensstijl is aanvullende suppletie vereist.
Ziekten en aandoeningen
Vanwege het grote belang van de biochemische reacties die door cobalaminen worden ondersteund, leidt een tekort aan vitamine B12 tot ernstige gezondheidsproblemen.
Een tekort kan enerzijds het gevolg zijn van een puur vegetarisch dieet en anderzijds het verlies van de intrinsieke factor. De intrinsieke factor is een glycoproteïne dat cobalamine in de dunne darm bindt en het dus omleidt naar gebruik. Dit eiwit wordt geproduceerd in de pariëtale cellen van de maag. Bij maagaandoeningen met falen van de pariëtale cellen kan geen intrinsieke factor meer worden gevormd. Het is niet meer mogelijk om de bestaande cobalamine opnieuw te gebruiken. Het gebrek aan vitamine B12 remt de methylering van homocysteïne tot methionine.
Het homocysteïnegehalte in het bloed neemt toe en het risico op aderverkalking neemt toe. Tegelijkertijd hoopt zich N5-methyl-tetrahydrofolaat ((N5-methyl-THF) op. THF is deficiënt. Als gevolg hiervan functioneert de nucleïnezuursynthese niet meer goed. Processen met een hoge nucleïnezuurbehoefte zoals bloedvorming worden geremd. Het aantal bloedcellen neemt af, waarbij de resterende erytrocyten in omvang toenemen naarmate ze gevuld zijn met hemoglobine.
Het resultaat is wat bekend staat als pernicieuze (kwaadaardige) anemie, die niet wordt veroorzaakt door ijzertekort. Het kan worden behandeld met foliumzuur. Het cobalamine-tekort blijft echter bestaan en veroorzaakt nog steeds neurologische klachten zoals kabelbaanmyelose of polyneuropathieën via de verstoring van methylmalonyl-CoA-mutase door de ophoping van methylmalonzuur in het plasma.



.jpg)

.jpg)
.jpg)


.jpg)