Hemopexin is een glycoproteïne dat vrij heem bindt en daardoor oxidatieve schade in weefsel tegengaat. De lever neemt het gecombineerde heem-hemopexinecomplex op en maakt het onschadelijk. Abnormale hemopexinewaarden kunnen bijvoorbeeld optreden bij kwaadaardig melanoom en hemolytische anemie.
Wat is Hemopexin?
Het eiwit hemopexine heeft een sterk vermogen om te binden aan heem, wat voorkomt in hemoglobine, enzymen en myoglobine. Ongebonden heem kan leiden tot oxidatieve stress, en daarom moet het lichaam het reguleren. Hemopexin is ook onder de naam Beta-18 glycoproteïne bekend.
Glycoproteïnen bestaan niet alleen uit eiwitten, maar bevatten ook een koolhydraatgehalte. Hemopexin is ook een van de bèta-globulines, een subgroep van globulines. Deze eiwitten komen voor in bloedserum en zijn niet oplosbaar in water. Hun taken zijn onder meer gerelateerd aan het immuunsysteem. Daarnaast hebben ze tal van specifieke functies als enzymen, biologische transportmoleculen of regulatoren van bloedeigenschappen, bijvoorbeeld de pH-waarde. Naast de bèta-globulinen zijn er drie andere groepen in het menselijk lichaam, die de biologie alfa-1, alfa-2 en gammaglobulinen noemt.
Functie, effect & taken voor lichaam en gezondheid
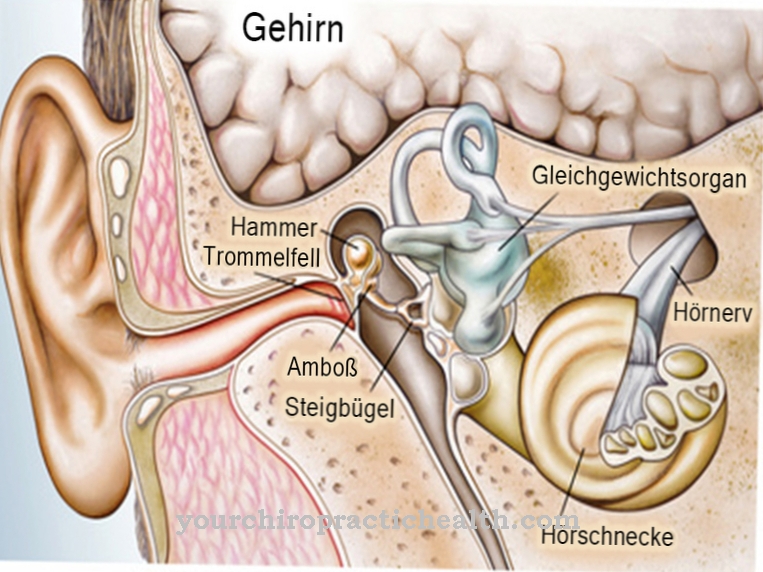
Wanneer hemopexine een vrij heemmolecuul in het bloed tegenkomt, vormen de twee stoffen een band met elkaar. In het bloed komt heem voor als onderdeel van het rode bloedpigment hemoglobine, dat ijzer bevat en een onderdeel is van rode bloedcellen (erytrocyten). Hun belangrijkste taak is om zuurstof te transporteren. In de spieren komt hemoglobine overeen met myoglobine, dat echter veel sterker zuurstof kan binden.
Door een haem-hemopexinecomplex te vormen, beschermt haemopexine het organisme tegen schade veroorzaakt door vrije heem, die schadelijke oxidatie van weefsel kan veroorzaken. Zogenaamde reactieve zuurstofsoorten bemiddelen in het proces. Deze stoffen omvatten radicalen zoals alkoxylradicalen, hydroxylradicalen en peroxylradicalen, maar ook hydroperoxide, hypochlorietanion, ozon en waterstofperoxide. Onder gecontroleerde omstandigheden gebruikt het menselijk lichaam dergelijke reactieve zuurstofsoorten om parasieten, bacteriën en virussen te bestrijden.
Bij de omzetting van energie in de mitochondriën komen ook kleine hoeveelheden reactieve zuurstofsoorten vrij. Maar vooral in hogere concentraties leiden ze tot oxidatieve stress, die niet alleen eiwitten en enzymen aantast, maar ook cytomembraan en genen. Als de oxidatie het gevolg is van vrij heem, kan hemopexine helpen om de schade te beperken of het proces preventief te stoppen voordat er grote schade optreedt.
Volgens sommige onderzoeken speelt hemopexine ook een rol bij ontstekingsprocessen. Onderzoekers waren echter in staat om zowel verhoogde als verlaagde hemopexine-waarden als correlaties te bepalen. De exacte regels die de onderliggende processen volgen, zijn nog niet definitief opgehelderd.
Opleiding, voorkomen, eigenschappen en optimale waarden
In zijn primaire structuur bestaat hemopexine uit 462 aminozuren die met behulp van peptidebindingen als bouwstenen in een lange keten zijn samengevoegd. Het gen HPX, dat bij mensen op het elfde chromosoom zit, is verantwoordelijk voor de synthese van het eiwit.
Als een blauwdruk definieert de genetische code de volgorde van de aminozuren binnen zo'n keten. Ribosomen gebruiken een kopie van DNA (het boodschapper-RNA of mRNA) om de genetische informatie in een polypeptide te vertalen. Nadat de translatie is voltooid, produceert de aminozuurketen plooien en neemt uiteindelijk de ruimtelijke structuur van hemopexine aan. Alleen in deze driedimensionale vorm is het bioproteïne volledig functioneel.
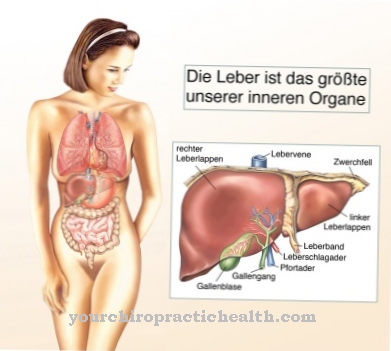
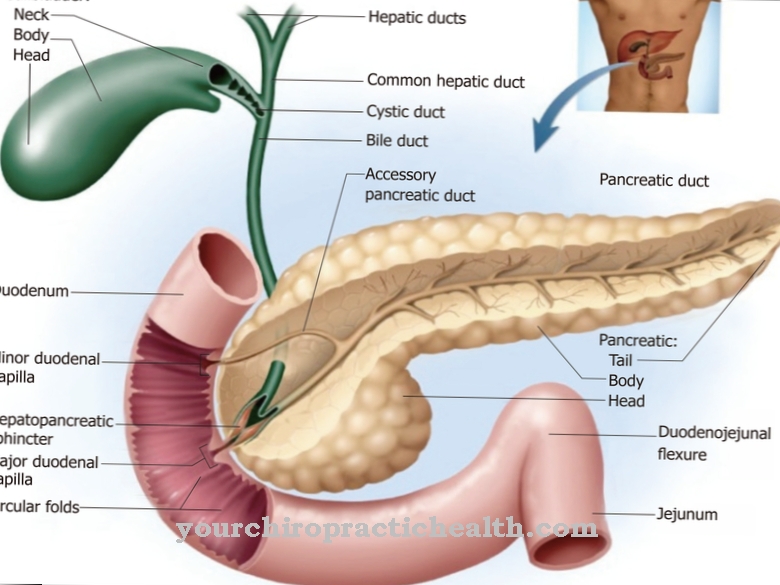
Hemopexin wordt gemaakt in de lever, die ook de meeste andere globulines synthetiseert. Bovendien is de lever verantwoordelijk voor het produceren van heem en absorbeert het hemopexine wanneer het heem heeft gebonden. Dit proces maakt deel uit van de natuurlijke bloedzuivering van het menselijk lichaam. De waarde voor hemopexine in het bloedserum bij gezonde mensen ligt in het bereik van 50 tot 115 mg per deciliter.
Ziekten en aandoeningen
Abnormale hemopexinespiegels kunnen optreden in de context van verschillende ziekten. Bij aanwezigheid van een kwaadaardig melanoom kan de gemeten concentratie toenemen. Kwaadaardige melanomen zijn kwaadaardige tumoren die uit de melanocyten groeien.
Melanocyten zijn huidcellen die het pigment melanine bevatten. Deze stof is niet alleen verantwoordelijk voor de kleur van de huid, maar neemt ook UV-licht op. Hoewel de absorptie niet volledig is, vormt dit mechanisme een belangrijke bescherming tegen mogelijk schadelijke straling.Uv-straling is een onderdeel van natuurlijk zonlicht. Overmatig zonnen en zonnebrand behoren daarom tot de risicofactoren die verband houden met de ontwikkeling van melanoom.
Kwaadaardig melanoom is ook bekend als zwarte huidkanker omdat de ziekte zich presenteert als een donkere tumor die bruin tot zwart van kleur is op de huid. Statistisch gezien verdwijnt het extern herkenbare melanoom echter bij ongeveer 20% van de getroffenen. Deze vorm van kanker verspreidt zich echter vaak in een vroeg stadium en leidt tot verdere zweren in andere regio's. Behandelingsopties omvatten chirurgische verwijdering van de tumor en, indien nodig, bestraling of chemotherapie. Als het kwaadaardige melanoom al is uitgezaaid, houdt de therapie hier ook rekening mee.
Bij hemolytische anemie daalt het hemopexinegehalte in het bloed doorgaans, aangezien deze vorm van anemie wordt gekenmerkt door de afbraak van rode bloedcellen (erytrocyten) die heem bevatten. Het hemopexine bindt het vrijgekomen heem en krijgt daardoor een andere algehele structuur met veranderde eigenschappen dan onbelast hemopexine. Tijdens een analyse kunnen laboratoriumtesten daarom een verlaagde hemopexine-waarde in het bloedserum vaststellen - in sommige gevallen is het eiwit helemaal niet meer detecteerbaar. Pathologische hemolyse komt voor in de context van verschillende ziekten, waaronder sikkel- en bolcelanemie, resus-onverenigbaarheid of malaria.



.jpg)







.jpg)

.jpg)
