De Xanthine-oxidase is verantwoordelijk voor de omzetting in urinezuur tijdens de afbraak van de purines. Een tekort aan of een remming van het enzym leidt tot een verlaging van de urinezuurspiegels in het bloed.
Wat is xanthine-oxidase?
Xanthine-oxidase is een enzym dat de reactie van hypoxanthine via xanthine op urinezuur activeert (katalyseert). Het bevat een niet-eiwitcomponent als een zogenaamde prothetische (Grieks, prothetos, bijgevoegde) groep, die verantwoordelijk is voor reactiviteit.
Dit is een afgeleide van flavine. Xanthine-oxidase is een van de flavine-enzymen. Het heeft ook ijzer en molybdeen in het actieve centrum. In 1902 werd het enzym voor het eerst beschreven als een bestanddeel van koemelk door de biochemicus F. Schardinger, zodat het voorheen het Schardinger-enzym heette. Onder invloed van dit enzym verandert de kleur van de kleurstof methyleenblauw, wat kan worden gebruikt als een typische detectiereactie om onderscheid te maken tussen rauwe en warmtebehandelde melk.
Het enzym wordt bij hoge temperatuur vernietigd. De kleurverandering is te wijten aan het feit dat de enzymen die aanwezig zijn in rauwe melk (zoals xanthine-oxidase) in aanwezigheid van formaldehyde het methyleenblauw verkleuren bij blootstelling aan lucht.
Functie, effect en taken
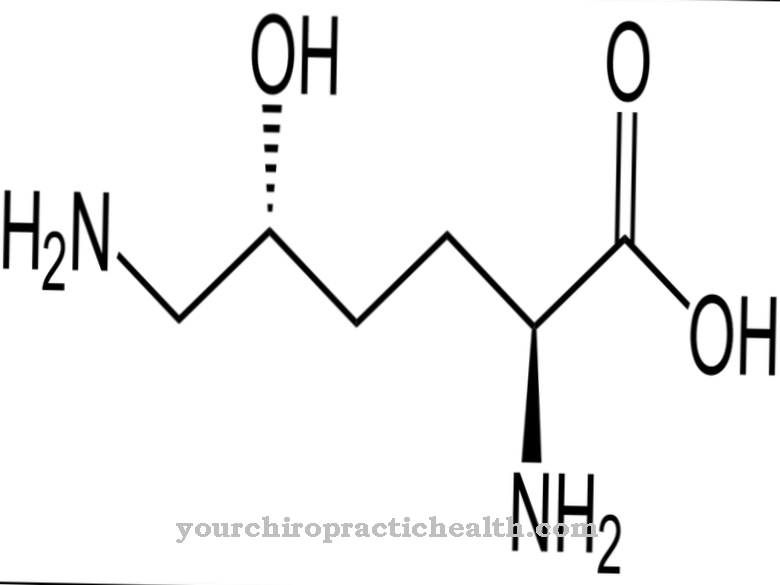
De bekendste taak van xanthine-oxidase is de vorming van urinezuur in het purinemetabolisme. Purines zijn aanwezig in elke cel. Ze maken deel uit van de nucleïnezuurbasen adenosine en guanine, waaruit samen met de pyrimidinebasen cytosine en thymine (of uracil) de nucleïnezuren DNA en RNA worden opgebouwd.
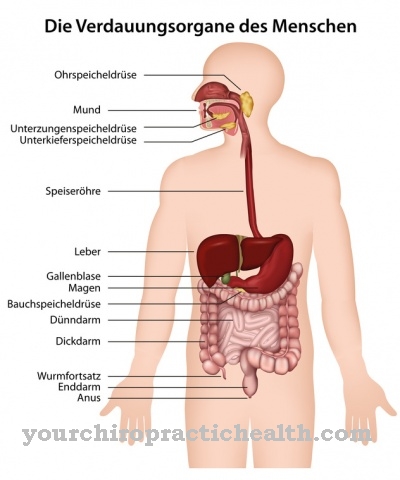
De genetische informatie in de verschillende cellen van het lichaam bestaat uit nucleïnezuren. Dit geldt voor mens en dier. Mensen met vleesproducten nemen bijvoorbeeld een grote hoeveelheid binnen in de vorm van dierlijk voedsel. Als de eigen lichaamscellen onder gaan of als dierlijke cellen die via voedsel het lichaam binnenkomen worden afgebroken, worden nucleïnezuren en dus ook purines aangemaakt. Deze worden omgezet in urinezuur. Onder invloed van xanthine-oxidase wordt aanvankelijk hypoxanthine gevormd en in een volgende stap xanthine, dat wordt omgezet in urinezuur en grotendeels via de nieren kan worden uitgescheiden. Slechts een klein deel van het urinezuur verlaat het lichaam via de darmen.
Als het lichaam grote hoeveelheden purine ophoopt of als de uitscheiding in de urine wordt beperkt, stijgt de urinezuurspiegel in het bloed. Een tweede enzym dat betrokken is bij de afbraak van purine, produceert ook urinezuur. Het heet xanthine dehydrogenase, gebruikt nicotinamide adenine dinucleotide (NAD) en is het overheersende enzym. Daarentegen heeft xanthine-oxidase een flavine-adenine-dinucleotidesubeenheid (FAD). Als de toevoer onvoldoende is, bijvoorbeeld door een gebrek aan bloedcirculatie, kunnen beide enzymen in elkaar worden omgezet.
Bij omzetting onder invloed van xanthine-oxidase, wordt waterstofperoxide ook gevormd als bijproduct. Waterstofperoxide is zelf geen radicaal, maar het is een reactieve stof. Daarom wordt het snel onschadelijk gemaakt door de werking van andere enzymen (peroxidase, catalase) in het lichaam.
Opleiding, voorkomen, eigenschappen en optimale waarden
De afbraak van purine vindt voornamelijk plaats in de lever. In het slijmvlies van de dunne darm is het enzym ook betrokken bij de opname van ijzer in het transporteiwit transferrine. Onderzoek heeft aangetoond dat het enzym wordt aangetroffen in cellen die zich in de binnenwand van bloedvaten bevinden. In deze context wordt ingegaan op de invloed ervan op het beloop van hart- en vaatziekten en schade veroorzaakt door oxidatieve stress.
Het aandeel oxidase ten opzichte van dehydrogenase als het enzymsysteem dat verantwoordelijk is voor het omzetten van purines in urinezuur is 20 procent. De vorm van xanthine dehydrogenase is voor 80 procent aanwezig. De flavine in xanthine-oxidase is een van de riboflavines, die identiek is aan vitamine B2. De molybdeen-subeenheid in xanthine-oxidase wordt gebonden door allopurinol, dat qua structuur sterk lijkt op purines. Op deze manier wordt het enzym bijna volledig geremd. De activiteit van het enzym kan indirect worden bepaald uit de hoeveelheid gevormd urinezuur.
Ziekten en aandoeningen
Bij maaltijden die rijk zijn aan purine of met verhoogde celdood, die bijvoorbeeld optreedt tijdens kankertherapie, wordt de xanthine-oxidase-reactie geactiveerd en worden grotere hoeveelheden urinezuur geproduceerd. Het urinezuurgehalte in het bloed stijgt.
Als het enzym wordt geremd, daalt de urinezuurconcentratie in het bloed. Dit effect is de basis van de medicatie bij jichtziekte. Bij jicht leiden de verhoogde urinezuurconcentraties tot kristallisatie en dus tot ongemak in de gewrichten. Medicijnen die allopurinol bevatten, zijn standaardpreparaten die worden gebruikt om jicht te behandelen. Bij de erfelijke vorm van enzymdeficiëntie wordt de activiteit verminderd door mutaties. Deze aandoening wordt op autosomaal recessieve wijze overgeërfd. Het kind wordt ziek als beide ouders een aangetast allel dragen. Een verminderde activiteit van xanthine-oxidase treedt ook op wanneer de molybdeencofactor ontbreekt omdat deze niet wordt gevormd als gevolg van een defect.
Xanthine en hypoxanthine hopen zich op. Significant verhoogde xanthinespiegels in het bloed en het verschijnen van xanthine in de urine (xanthinurie) zijn merkbaar bij de getroffenen. Bij het bepalen van xanthine om enzymdeficiëntie op te sporen, moeten voedingsmiddelen zoals koffiebonen, thee, mate of aardappelen worden uitgesloten als bron van xanthine. De urinezuurspiegels worden daarentegen verlaagd. Omdat xanthine niet wordt afgebroken en matig oplosbaar is, kan het kristallen vormen. In de meeste gevallen is de ziekte symptoomvrij. Voor anderen kan het echter nierproblemen, urineweginfecties of bloed in de urine veroorzaken.
Als zich bij een ernstige ziekte xanthinestenen vormen, kunnen ze worden afgezet in het nierweefsel of in de urinewegen. De getroffenen moeten voorzichtig zijn met een dieet met een laag purinegehalte en veel drinken.

.jpg)








.jpg)


.jpg)