fluor vertegenwoordigt een chemisch element met atoomnummer 9 en behoort tot de halogenen. Het is een sterk corrosief gas, dat ernstige schade aan de slijmvliezen veroorzaakt. Fluor wordt medicinaal gebruikt in de vorm van zijn zouten, het fluoride, om tanden te versterken.
Wat is fluor?
Fluor is een sterk bijtend en reactief gas, geen verbinding, maar een chemisch element dat tot de halogenen behoort. Met atoomnummer 9 is het het lichtste halogeen. In de natuur komt fluor voornamelijk voor in de vorm van zijn zouten, de fluoriden.
Het gas fluor is niet erg stabiel en reageert met bijna alle verbindingen en elementen direct na zijn productie. Alleen bij de edelgassen helium en neon is er geen reactie. Deze buitengewoon sterke reactiviteit kan worden verklaard door zijn zeer sterke affiniteit voor elektronen. Het onttrekt altijd elektronen aan zijn reactiepartners en is daarom het sterkste oxidatiemiddel. De naam fluor is afgeleid van het Latijnse "fluorescerende stof" (rivier). Als calciumfluoride (vloeispaat) dient het als vloeimiddel voor ertsen.
Wanneer vloeispaat wordt toegevoegd aan ertsen, verlaagt het hun smeltpunt, zodat ze sneller vloeibaar worden. Conceptueel gezien is er in de geneeskunde de term fluor genitalis voor de bloedeloze afvoer van secretie uit de vrouwelijke genitaliën. Genitale fluor mag echter niet worden verward met het element fluor.
Functie, effect en taken
Fluor wordt een essentieel sporenelement genoemd. Het belang van fluor is echter omstreden. Het is bekend dat fluoriden beschermende eigenschappen hebben tegen tanden. Fluoride kan de tanden versterken en tegelijkertijd bepaalde enzymen van cariësbacteriën remmen, die de afbraak van koolhydraten veroorzaken.
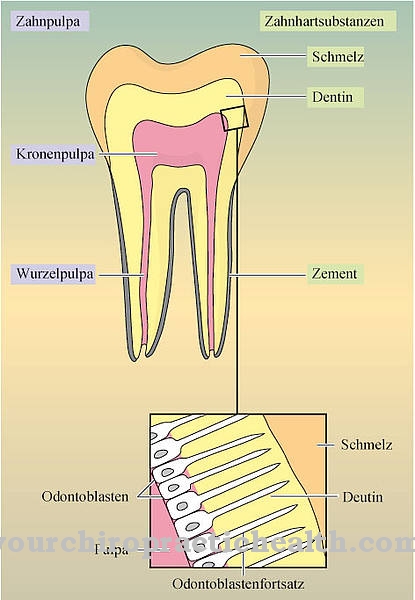
De fluoriden werken direct op de tand. Orale inname van fluoride heeft geen effect op de tanden. De tanden bestaan voornamelijk uit het mineraal hydroxyapatiet. Hydroxyapatiet kan worden aangetast door zuren die worden geproduceerd door de afbraak van voedselresten. Slechte mondhygiëne resulteert daarom vaak in gaatjes in het gebit die nog bezet zijn door cariësbacteriën. Als de tandpasta bijvoorbeeld fluoride bevat, is er een uitwisseling van hydroxylionen voor fluoride-ionen. Hierdoor ontstaat fluorapatiet, wat een harder materiaal blijkt te zijn en minder kwetsbaar voor zuren. Zelfs door zuren opgelost hydroxyapatiet kan in aanwezigheid van fluoriden weer als fluorapatiet worden neergeslagen.
Een beginnende vernietiging kan dus worden teruggedraaid. Maar fluoriden hebben ook positieve eigenschappen voor het bouwen van botten. Hier vindt de intake mondeling plaats. Kinderen en baby's krijgen fluoride en vitamine D om rachitis te voorkomen. Fluoride mag echter niet worden overdosis, zodat fluorose met verstijving en verdikking van de gewrichten niet kan ontstaan. Fluorverbindingen zijn ook goedgekeurd als geneesmiddelen voor osteoporose. De bijbehorende tabletten bevatten natriumfluoride of dinatriumfluorfosfaat.
Opleiding, voorkomen, eigenschappen en optimale waarden
Fluor zit in de vorm van fluoriden in zwarte en groene thee, asperges en ook in vis. Veel zouten bevatten fluoride. Er zijn geen zuivere fluorzouten vanwege de lage oplosbaarheid van fluoridehoudende verbindingen in water. Vloeispaat (calciumfluoride) en fluorapatiet komen het meest voor in de aardkorst.
Fluor wordt voornamelijk gemaakt van calciumfluoride. Er zijn zelfs organismen die organofluorverbindingen kunnen maken. De Zuid-Afrikaanse Gifblaar of planten van het geslacht Dichapetalum kunnen fluorazijnzuur synthetiseren tegen roofdieren. Het menselijk organisme heeft een dagelijkse behoefte van 0,25-0,35 mg.
Ziekten en aandoeningen
Fluor-gerelateerde vergiftiging en gezondheidsproblemen komen echter vaker voor. Zoals eerder vermeld, is pure fluor een zeer giftig bijtend gas. Dit is ook wat het moeilijk maakt om fluor te maken.
Omdat het met bijna alle materialen reageert, kan het ook zeer slecht worden opgeslagen en vervoerd. Bij vergiftiging met fluor treden chemische brandwonden en brandwonden op in de longen, op de huid en in de ogen. Afhankelijk van de dosis lossen de betreffende organen binnen korte tijd op, met de dood tot gevolg. De dodelijke dosis is erg laag en bedraagt 185 ppm. Fluorvergiftiging met pure fluor zal zelden voorkomen omdat het gas niet stabiel is. Waterstoffluoridevergiftiging is echter even gevaarlijk. Waterstoffluoride vormt waterstofbruggen met de eiwitten in het lichaam, waardoor de tertiaire structuur van de eiwitten wordt vernietigd. Er vindt een denaturatie van lichaamseiwitten plaats.
Fluoriden kunnen met aluminiumionen complexe verbindingen vormen die een vergelijkbaar effect hebben als fosfaten. In het lichaam grijpen deze verbindingen in bij de fosforyleringsreacties. Dit leidt onder meer tot deregulering van de G-eiwitten, waardoor veel enzymen worden geremd. Alleen al om deze reden wordt een verhoogde dosis fluoride niet door het lichaam verdragen. Het innemen van te veel fluoridetabletten kan ook leiden tot misselijkheid, braken en diarree. Het fluoride reageert met het maagzuur, waarbij een kleine hoeveelheid fluorwaterstofzuur wordt gevormd. Dit tast de slijmvliezen aan. Een chronische, milde overdosis fluoride kan leiden tot fluorose.
Fluorose is een chronische fluorvergiftiging met veranderingen in de structuur van het tandglazuur, hoesten, sputum en kortademigheid. Te veel hydroxyapatiet verandert in fluorapatiet in de tanden. De tanden worden brozer. De botten veranderen ook door de overmatige vorming van fluorapatiet. De botten verstijven langzaam en hermodelleren. Bovendien wordt het enzym enolase geremd.









.jpg)