De Fosforylering is een fundamenteel proces van biochemie dat niet alleen plaatsvindt in het menselijk organisme, maar in alle levende wezens met een celkern en bacteriën. Het is een onmisbaar onderdeel van intracellulaire signaaltransductie en een belangrijke manier om celgedrag te controleren. Meestal worden componenten van eiwitten gefosforyleerd, maar ook andere moleculen, zoals suiker, kunnen als substraat dienen. Vanuit chemisch oogpunt creëert fosforylering van eiwitten een fosforzuuresterbinding.
Wat is fosforylering?

De term fosforylering beschrijft de overdracht van fosfaatgroepen naar organische moleculen - meestal zijn dit de aminozuurresten waaruit eiwitten bestaan. De fosfaten hebben een tetraëdrische structuur die bestaat uit een centraal fosforatoom en vier omringende, covalent gebonden zuurstofatomen.
Fosfaatgroepen hebben een dubbele negatieve lading. Ze worden door specifieke enzymen, zogenaamde kinasen, overgebracht naar een organisch molecuul. Bij energieverbruik binden deze het fosfaatresidu meestal aan een hydroxylgroep van een eiwit, zodat een fosforzuurester wordt gevormd. Dit proces is echter omkeerbaar, d.w.z. het kan worden teruggedraaid, ook weer door bepaalde enzymen. Dergelijke enzymen die fosfaatgroepen afsplitsen, worden in het algemeen fosfatasen genoemd.
Zowel de kinasen als de fosfatasen vertegenwoordigen elk hun eigen enzymklasse, die kan worden onderverdeeld in verdere subklassen volgens verschillende criteria zoals het type substraat of het activeringsmechanisme.
Functie en taak
Een cruciale rol van fosfaten, vooral polyfosfaten, in het organisme is de energievoorziening. Het meest prominente voorbeeld hiervan is ATP (adenosinetrifosfaat), de belangrijkste energiedrager in het lichaam. Energieopslag in het menselijk organisme betekent daarom meestal de synthese van ATP.
Om dit te doen, moet een fosfaatresidu worden overgebracht naar een ADP-molecuul (adenosinedifosfaat) zodat de keten van fosfaatgroepen, die via fosforzuuranhydridebindingen met elkaar zijn verbonden, wordt verlengd. Het resulterende molecuul wordt ATP (adenosinetrifosfaat) genoemd. De energie die op deze manier wordt opgeslagen, wordt verkregen uit de hernieuwde splitsing van de binding, waardoor ADP achterblijft. Ook kan nog een fosfaat worden afgesplitst, waardoor AMP (adenosine monofosfaat) wordt gevormd. Elke keer dat een fosfaat wordt afgesplitst, heeft de cel meer dan 30 kJ per mol beschikbaar.
Suiker wordt om energetische redenen ook gefosforyleerd tijdens het metabolisme van menselijke koolhydraten. Men spreekt ook van een "opvangfase" en een "herstelfase" van glycolyse, aangezien energie in de vorm van fosfaatgroepen eerst in de uitgangsmaterialen moet worden geïnvesteerd om later ATP te verkrijgen. Bovendien kan glucose, bijvoorbeeld als glucose-6-fosfaat, niet langer ongehinderd door het celmembraan diffunderen en wordt het daardoor in de cel gefixeerd, waar het nodig is voor andere belangrijke metabolische stappen.
Bovendien vertegenwoordigen fosforyleringen en hun omgekeerde reacties, naast allostere en competitieve remming, de beslissende mechanismen voor het reguleren van celactiviteit. Meestal worden eiwitten gefosforyleerd of gedefosforyleerd. De aminozuren serine, threonine en tyrosine in eiwitten worden het vaakst gemodificeerd, waarbij serine betrokken is bij de overgrote meerderheid van fosforyleringen. Bij eiwitten met enzymactiviteit kunnen beide processen zowel tot activering als inactivering leiden, afhankelijk van de structuur van het molecuul.
Als alternatief kan de (de) fosforylering door het overbrengen of verwijderen van een dubbele negatieve lading er ook toe leiden dat de conformatie van het eiwit zodanig verandert dat bepaalde andere moleculen kunnen binden aan de aangetaste eiwitdomeinen of gewoon niet meer. Een voorbeeld van dit mechanisme is de klasse van aan G-proteïne gekoppelde receptoren.
Beide mechanismen spelen een uitstekende rol bij de overdracht van signalen binnen de cel en bij de regulering van het celmetabolisme. Ze kunnen het gedrag van een cel beïnvloeden, hetzij direct via de enzymactiviteit, hetzij indirect via veranderde transcriptie en translatie van het DNA.
Ziekten en aandoeningen
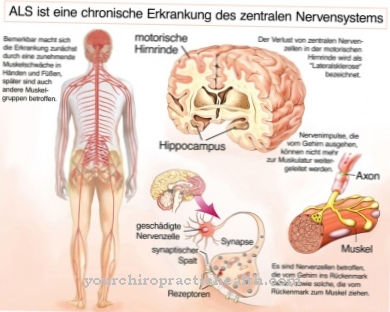
Even universeel en fundamenteel als de functies van fosforyleringen, zijn de gevolgen van een verstoring van dit reactiemechanisme net zo divers. Een defect of een remming van fosforylering, meestal veroorzaakt door een tekort aan proteïnekinasen of hun schade, kan onder meer leiden tot stofwisselingsziekten, ziekten van het zenuwstelsel en spieren of individuele orgaanschade. Zenuw- en spiercellen worden vaak het eerst aangetast, wat zich uit in neurologische symptomen en spierzwakte.
Bepaalde aandoeningen van de kinasen of fosfatasen kunnen in beperkte mate door het lichaam worden gecompenseerd, aangezien er soms meerdere manieren zijn om een signaal door te sturen en zo het "defecte punt" in de signaalketen kan worden omzeild. Dan vervangt bijvoorbeeld een ander eiwit het defecte eiwit. Een verminderde efficiëntie van de enzymen kan daarentegen worden gecompenseerd door simpelweg de productie te verhogen.
Interne en externe toxines, evenals genetische mutaties, zijn mogelijke oorzaken van een tekort of storing van kinasen en fosfatasen.
Als een dergelijke mutatie plaatsvindt in het DNA van de mitochondriën, zijn er negatieve effecten op oxidatieve fosforylering en dus op ATP-synthese, de hoofdtaak van deze celorganellen. Zo'n mitochondriale ziekte is bijvoorbeeld LHON (Leber erfelijke optische neuropathie), waarbij sprake is van een snel verlies van gezichtsvermogen, soms in combinatie met hartritmestoornissen. Deze ziekte wordt via de moeder overgeërfd, d.w.z. uitsluitend van de moeder, aangezien alleen haar mitochondriaal DNA wordt doorgegeven aan het kind, maar niet dat van de vader.










.jpg)

.jpg)
.jpg)
