De Enteropeptidase is een enzym van het slijmvlies van de twaalfvingerige darm waarvan de functie is om de pancreasenzymen te activeren. Het staat aan het begin van een hele activeringscascade van spijsverteringsenzymen. Een disfunctie van enteropeptidase leidt tot slechte spijsvertering en slechte opname van voedsel in de dunne darm.
Wat is een enteropeptidase?
Enteropeptidase is een enzym van het slijmvlies van de twaalfvingerige darm, dat de spijsverteringsenzymen van de pancreas activeert door trypsinogeen voor trypsine te activeren.
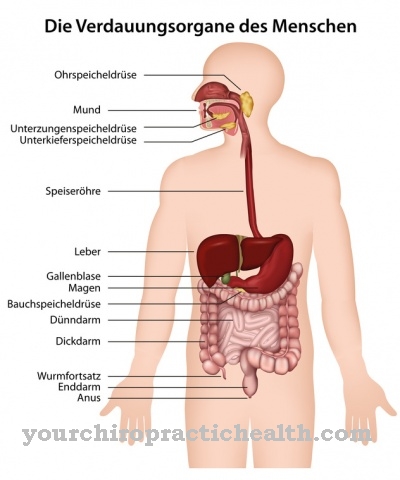
Enteropeptidase wordt uitgescheiden in de borstelrand van het slijmvlies van de twaalfvingerige darm. In het bijzonder zijn de klieren van liebekühn verantwoordelijk voor de afscheiding. De klieren van liebekühn zijn buisvormige depressies in het epitheel van de dunne en dikke darm. In de dunne darm bevinden ze zich tussen de dunne darmvlokken. De klieren, ook wel Lieberkühn-crypten genoemd, scheiden naast enteropeptidase een groot aantal enzymen uit. De afscheiding van enteropeptidase wordt gestimuleerd wanneer de chymus, die voorverteerd is in de maag, de twaalfvingerige darm binnengaat. Het enzym alleen heeft geen invloed op de voedselcomponenten.
Alleen de activering van het enzym trypsine zet de hele activeringscascade van de spijsverteringsenzymen in beweging. Enteropeptidase is, net als trypsine en de andere proteasen van de pancreas, een serineprotease. Het actieve centrum bevat de katalytische triade van asparaginezuur, histidine en serine. Als endopeptidase splitst enteropeptidase de eiwitten alleen op bepaalde karakteristieke punten met bepaalde herkenningsmotieven in de aminozuursequentie. Het enzym splitst altijd op het herkenningsmotief van Asp-Asp-Asp-Asp-Lys. Met trypsinogeen wordt het hexapeptide Val- (Asp) 4-Lys gesplitst, waarbij trypsine wordt gevormd.
Functie, effect en taken
De functie van enteropeptidase is om de spijsverteringsenzymen in de pancreas te activeren. Het start pas de eerste stap van activering met de omzetting van trypsinogeen in trypsine.
Trypsine is op zijn beurt een serineprotease dat eiwitten splitst op basis van hetzelfde karakteristieke herkenningsmotief. Het zet nu de activering van trypsinogeen zelf voort. Tegelijkertijd activeert het andere pancreasenzymen uit hun respectievelijke voorlopers, zoals chymotrypsinogeen, pro-elastase, pro-carboxypeptidase, pro-fosfolipase en proenteropeptidase. Enteropeptidase bevindt zich aanvankelijk ook in de inactieve vorm. Wanneer de chymus de twaalfvingerige darm binnengaat, wordt niet alleen proenteropeptidase maar ook duodenase uitgescheiden, wat de proform van enteropeptidase activeert. Na de start van de activeringscascade neemt trypsine de activering van alle pancreasenzymen over, inclusief proenteropeptidase en trypsinogeen.
De activering van proenteropeptidase tot enteropeptidase vindt zelfs effectiever plaats door de werking van trypsine dan via duodenase. De primaire aanwezigheid van de spijsverteringsenzymen in hun inactieve vorm is buitengewoon belangrijk. Vooral de werking van de proteasen is niet specifiek. Alle eiwitten die het kenmerkende herkenningsmotief in het molecuul bevatten, worden hydrolytisch gesplitst. Als de enzymen direct katalytisch actief waren, zouden de lichaamseigen eiwitten al worden verteerd in de alvleesklier en het pancreaskanaal. Als gevolg hiervan lost de alvleesklier zichzelf op. Activering vindt alleen plaats in de twaalfvingerige darm buiten de exocriene klieren.
De enzymen kunnen hier beginnen met het afbreken van de voedselcomponenten zonder de eigen weefsels van het lichaam aan te vallen. Om te voorkomen dat de enzymen voortijdig worden geactiveerd, werkt een extra trypsineremmer in het kanaal van de alvleesklier. De sleutelrol voor de spijsverteringscascade wordt echter gespeeld door trypsine. Zodra dit enzym is geactiveerd, kan de activering van alle spijsverteringsenzymen, inclusief enteropeptidase, niet worden gestopt.
Opleiding, voorkomen, eigenschappen en optimale waarden
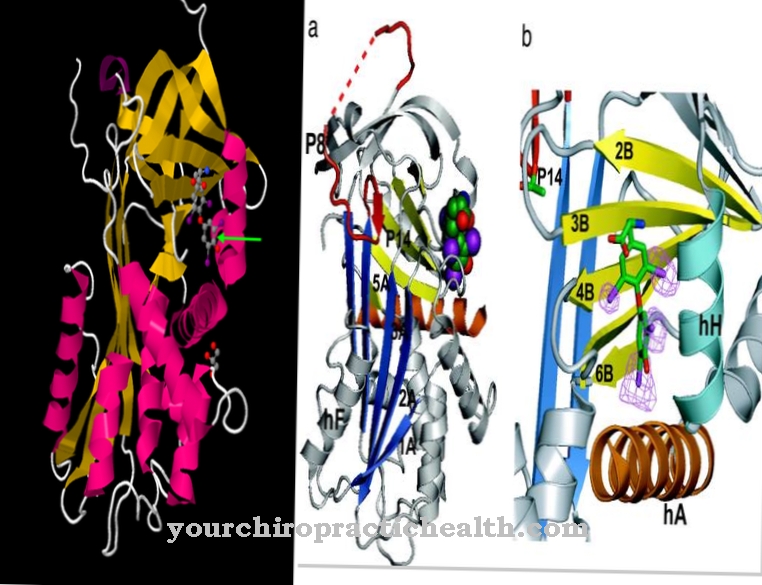
Net als alle serineproteasen heeft enteropeptidase ook een niet-specifiek effect en splitst het de eiwitten met behulp van een kenmerkend herkenningsmotief. Enteropeptidase bestaat uit een lichte en een zware keten die zijn verbonden door disulfidebruggen. Het serineprotease-domein bevindt zich op de lichte keten.
De zware keten heeft een molecuulmassa van 82 tot 140 kilodalton, waarbij de molecuulmassa van de lichte keten 35 tot 62 kilodalton is. De structuur van de lichte keten van enteropeptidase is vergelijkbaar met de andere serineproteasen trypsine en chymotrypsine. De zware keten is membraangebonden en beïnvloedt de specificiteit van het enzym. Er werd gevonden dat de geïsoleerde lichte keten een vergelijkbaar effect heeft tegen het karakteristieke herkenningsmotief - (Asp) 4-Lys-, maar een significant lager effect tegen trypsinogeen.
Ziekten en aandoeningen
De menselijke enteropeptidase wordt gecodeerd door het ENTK-gen op chromosoom 21. Een mutatie van dit gen kan bij de getroffen kinderen tot ernstige ziekten leiden.
Het enzym kan de andere spijsverteringsenzymen niet meer activeren. De voedingscomponenten worden niet meer afgebroken en kunnen dus niet meer door de dunne darm worden opgenomen. Het is vooral een kwestie van slechte vertering (onvoldoende afbraak), wat leidt tot slechte opname van de voedingsbestanddelen. Het lichaam wordt niet langer voldoende van voedingsstoffen voorzien. Gebrek aan gedijen, groeiachterstand en typische symptomen van eiwittekort met de ontwikkeling van oedeem treden op. Tegelijkertijd worden naast eiwitten ook koolhydraten en vetten slecht opgenomen. Omdat de onverteerde voedingsbestanddelen in de dikke darm terechtkomen en daar worden afgebroken door fermentatie en rottende bacteriën, komen ook winderigheid, diarree en buikpijn voor.
Tot dusver zijn wereldwijd 15 gevallen van aangeboren enteropeptidasedeficiëntie beschreven. De symptomen van de aandoening komen echter veel vaker voor. Een enteropeptidase-deficiëntie hoeft niet altijd aanwezig te zijn. Omdat trypsine een sleutelrol speelt bij het activeren van spijsverteringsenzymen, leidt een defect of tekort aan trypsine ook tot vergelijkbare symptomen. De behandeling van deze ziekten is in beide gevallen hetzelfde. De enzymen worden in geactiveerde vorm toegediend. Er zijn zeker veel meer niet-gediagnosticeerde gevallen van enteropeptidasedeficiëntie.
Als de diagnose zeker is, kan enteropeptidase ook worden vervangen. Een enteropeptidase-deficiëntie wordt ook secundair veroorzaakt door ernstige darmaandoeningen.Ziekten zoals coeliakie, verkorte dunne darm, lactasedeficiëntie of andere moeten worden verduidelijkt in de differentiële diagnose.

.jpg)

.jpg)







.jpg)


.jpg)